Contents of the package
Catalogue number: PPTK1
- 2×30 cm Silicon tubes
- 1×9.5 cm Bioprene tube
- 2 pcs Female Luer connectors
- 4 pcs Male Luer connectors
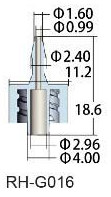 |
300 mm Silicon tube Internal diameter 1 mm |
 |
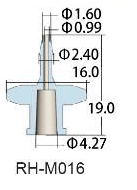 |
95 mm Watson Marlow Bioprene tube Internal diameter 1 mm |
 |
JFermi BioCore installations are licensed on a per-device basis. One device can be used by any number of browser clients.
If you comply with these license terms, you have the rights below:
INSTALLATION AND USE RIGHTS
Commercial use
If you wish to embed JFermi Biocore in your Bioreactor you may use the software to control your fermentation process and develop your own control schema after purchasing an Embedder License. Please contact us.
SCOPE OF LICENSE
The software is licensed, not sold. This agreement only gives you some rights to use the software. JFermi reserves all other rights. Unless applicable law gives you more rights despite this limitation, you may use the software only as expressly permitted in this agreement. In doing so, you must comply with any technical limitations in the software that only allow you to use it in certain ways. You may not
- work around any technical limitations in the software;
- reverse engineer, decompile, pretty print or disassemble the software, or otherwise attempt to derive the source code for the software except, and solely to the extent: (i) permitted by applicable law, despite this limitation; or (ii) required to debug changes to any libraries licensed under the GNU Lesser General Public License which are included with and linked to by the software;
- remove, minimize, block or modify any notices of JFermi
- use the software in any way that is against the law;
- share, publish, or lend the software, or provide it as a hosted solution for others to use, or transfer the software or this agreement to any third party.
SUPPORT SERVICES
We provide support service at http://bugs.jfermi.com
ENTIRE AGREEMENT
This agreement, and the terms for supplements, updates, Internet-based services and support services that you use, are the entire agreement for the software and support services.
LEGAL EFFECT
This agreement describes certain legal rights. You may have other rights under the laws of your state or country. This agreement does not change your rights under the laws of your state or country if the laws of your state or country do not permit it to do so.
DISCLAIMER OF WARRANTY
The software is licensed “as-is.” You bear the risk of using it. JFermi gives no express warranties, guarantees or conditions. To the extent permitted under your local laws, JFermi excludes the implied warranties of merchantability, fitness for a particular purpose and non-infringement.
LIMITATION ON AND EXCLUSION OF DAMAGES
You cannot recover any damages, including consequential, lost profits, special, indirect or incidental damages. This limitation applies to (a) anything related to the software, services, content (including code) on third party Internet sites, or third party applications; and (b) claims for breach of contract, breach of warranty, guarantee or condition, strict liability, negligence, or other tort to the extent permitted by applicable law. It also applies even if JFermi knew or should have known about the possibility of the damages. The above limitation or exclusion may not apply to you because your state or country may not allow the exclusion or limitation of incidental, consequential or other damages.
LICENSE EXPIRATION
JFermi licence is “perpetual” – your software will continue to work as it did before it expired.
There are some minor differences:
- You can’t raise support requests
- You can’t upgrade to any version released after the end of the licence
DISTRIBUTION RESTRICTION
You may not:
- alter any copyright, trademark or patent notice in JFermi BioCore;
- modify or distribute the source code so that any part of it becomes subject to an Excluded License.
GENERAL TERMS AND CONDITIONS OF SALE

- OPPOSABILITY OF jFERMI’S GENERAL PURCHASING CONDITIONS
jFermi’s General Purchasing Conditions govern each order submitted to jFermi Biotechnológiai Kft. (registered seat: H-8146 Jenő, Hősök utca 22, Hungary, hereinafter “jFermi”) and supersede any sale or purchase terms, except for an express and written agreement of jFermi to the contrary.
By signing the “Order”, the “Declaration on Purchase of the Device” the Customer fully agrees, without reserve, to these jFERMI’S General Sale Conditions and renounces to its general purchase terms (if any); notwithstanding their appearance on its quotations, proposals, acknowledgement of receipt, mailing, bills.
2. DEFINITIONS
- “Agreement” means the terms and conditions of the present GTC and the Declaration(s) signed by the Customer
- “Customer” means the party contracting with jFermi.
- “Declaration” means any of the following documents being Annex 1-3 of this GTC: “Order”, the “Declaration on Purchase of the Device”.
- “Device” means the bioreactor, being the subject of the Agreement between the Parties.
- “GTC” means the present General Terms and Conditions of Sale of jFermi.
- “jFermi” means jFermi Biotechnológiai Kft, a Hungarian company having its registered seat at H-8146 Jenő, Hősök utca 22, Hungary.
- “Order” means the Customer’s unique delivery order specifying the Device.
- “Parties” means jFermi and the Customer together.
- “Party” means jFermi or the Customer.
- “Testing Period” means a half-year long period after the handover of the Device to the Customer.
3. ORDER
The Order (being Annex 1) of the Customer shall be sent to jFermi. jFermi will indicate the estimated date of delivery of the Device in its confirmation of the Order within 15 days after its receipt. jFermi reserves the right not to accept an Order or suspend it if it considers the Customer’s position presents a solvency risk or in the event of the Device not being available.
If the Customer does not make any decision until the end of the testing period on the Purchase or Return of the Device, jFermi may issue its invoice on a 20,000 (TWENTY thousand) EUR penalty payment by a payment term of 15 days on the first working day following the last day of the Testing Period.
4. DELIVERY
Shipping fees for the initial delivery of the Device shall be covered by the Customer. Any customs duties, taxes, or additional fees incurred during shipping will be the responsibility of the Customer. The Customer must arrange and cover the shipping fees for returning the Device to jFermi (if relevant). The Device must be returned in its original condition and packaging.
The delivery of the Device shall be subject to the terms of the EXW (Ex Works) Incoterms clause.
If the Customer shall return the Device to jFermi, this transfer shall be ordered by jFermi, which shall bear the cost of this transfer.
5. TRAINING
The Device shall be delivered together with the instructions for use. During the Trial Period, jFermi shall provide a one-time online training and regular online support for the use of the Device. The conditions for the one-time online training (date, timeframe, number of participants) will be defined by the Customer and jFermi.
6. PURCHASE OF THE DEVICE
At the latest 3 calendar days before the end of the Testing Period, the Customer may decide on the purchase of the Device by sending the signed Declaration on Purchase of the Device (being Annex 2) to jFermi’s registered seat. The testing fee will be deducted from the total purchase price. The remaining balance must be paid within 15 calendar days from the decision to purchase.
7. PRICING and PAYMENT
Any payment shall be transferred to the to jFermi’s bank account indicated in its invoice within 15 days of its receipt. VAT at the rate in force on the day of shipment will be added to ex-VAT prices. The cost of bank transfers shall be borne by the Party who instructed the bank to make the transfer. Invoices will be transmitted in paper or dematerialised format.
If the customer does not contest invoices within 30 days of the date of issuance, the amounts of the said invoices will be considered accepted.
In the event of overdue payment, late penalties will be due by the Customer to jFermi on the day following the payment date indicated on the invoice and are applicable ipso jure. The amount of these penalties is calculated on the basis of the Central European Bank base rate plus ten (10) percentage points. A fixed indemnity of €40 for collection charges will also be charged. jFermi may claim additional compensation for any expenses incurred to collect the sums owed.
Without prejudice to the above, in the event of (i)non-payment of a single due amount by the Customer, (ii) non-observance of payment conditions or (iii) if jFermi was to consider that the Customer’s financial position presented a solvency risk, jFermi is entitled to:
– immediately cease all payment facilities and special commercial conditions granted;
– suspend or cancel any ongoing orders without notification or an indemnity;
– require cash payment before each shipment for any subsequent deliveries, or any other secure method of payment chosen by jFermi;
– require immediate payment of the entire balance due.
8. TRANSFER OF RISK AND OWNERSHIP
The delivered Device remain the property of jFermi until the purchase price is paid in full. jFermi reserves the right to use all available means to take back the Device or have it taken back in the event of non-payment, since failure to make payment may lead to the Device being claimed back. The part of the price already paid remains the property of jFermi as a counterpart to enjoyment of the Device. The provision of a financial instrument creating an obligation to pay does not constitute payment in the sense of this clause.
jFermi accepts responsibility for the risks and transportation costs for the Device. The risk is transferred to the Customer upon delivery of the Device, from which date onwards the Customer is responsible for any damage that might be caused to the Device or because of the Device. The Customer shall therefore ensure that its insurance covers the Device from this point in time.
9. CONTACT; DECLARATIONS
The Parties shall consider exchanges of English language messages by e-mail using info@jfermi.com for jFermi and the e-mail address given in the Order for the Customer, to be valid and effective between themselves. No amendment or addition to the Agreement shall be made via e-mail except by a document signed by the Parties.
The Contact persons are not entitled to make any binding statement concerning the conclusion, content, amendment or termination of the Agreement. Such a statement shall be made exclusively by the contracting (natural) person itself, the representative(s) of the contracting party registered in the Company Register, or their representative having a power of attorney.
10. WARRANTIES
jFermi expressly warrants that the Device is its exclusive property and that the Device is free from all claims, encumbrances and demands, is not subject to judicial attachment and that there are no circumstances in the jFermi’s interest which would prevent or hinder the Customer from obtaining ownership.
The Seller warrants the Device to be free from defects for a period of one year from the date of delivery.
In any event, the Customer must comply with the conditions for using the Devices, applicable to it.
Throughout the warranty period, jFermi, or a specialist company operating on its behalf, will be responsible for making repairs and supplying spare parts relating to correct system operation, with the exception of consumables and similar items.
The jFermi warranty cannot be applied to a Device that is handled or used in a manner non-compliant with jFermi instructions for use. Any damage caused by improper use, negligence, or unauthorized modifications will void the warranty.
11. LIABILITY
The Customer shall hold harmless jFermi against any third-party action involving the consequences of non-compliant use of the Device. The Customer is responsible for the integrity of the Device until returned to jFermi. Any costs incurred or prejudice suffered due to the Customer’s negligence and/or any breach in the above-mentioned obligations will give rise to compensation payable to jFermi.
jFermi’s responsibility for any loss or damage resulting from any cause, including its negligence, cannot under any circumstances exceed the selling price of the Device covered by the complaint or at the source of the loss or damage. Alternatively, at the discretion of jFermi, the Device concerned may be repaired or replaced and shipment costs paid. jFermi cannot be held liable for any indirect, intangible or similar damage, whether action is for contractual or tortious liability or other.
12. TRADE SECRETS
The Parties hereby expressly acknowledge the confidentiality of all information that they become aware of during the negotiation and performance of the Order (especially the price and the technical description of the Device).
Consequently the Parties undertake not to disclose or directly or indirectly use or have others disclose or directly or indirectly use any confidential notice, data, information, application or method as well as any document that they become aware of during the negotiation and the performance of their obligations, without the other Party’s expressed and prior written consent. The secrecy shall also be kept by the employees and the contributories of the Parties.
13. VIS-MAJOR
There shall be no liability for delay or failure to perform the Order if caused by unforeseeable circumstances beyond the control of jFermi, including in particular natural disasters, military operations and extraordinary governmental measures. JFermi shall immediately notify the Customer of such unforeseen force majeure.
In such a case, the force majeure shall automatically extend the time limit for the performance of the obligations by the period of the force majeure from the date of receipt of the notification by the other Party.
14. TRANSFER/SALE
The Customer will refrain from the transfer/sale or transmission in any manner of its rights and obligations arising from its business relations with jFermi to a third-party, which is a jFermi competitor.
The Customer hereby agrees that jFermi may transfer the order or undergo a change in control to the benefit of a third party.
The Customer shall refrain from selling the Devices to any third parties.
15. TERMINATION
If either Party fails to perform a material obligation (delivery of the Device or payment), the other Party may terminate their Agreement in writing with immediate effect, without prejudice to its right to compensation, as from the date on which its request for performance sent to the other Party has proved ineffective, even after a period of 15 (fifteen) days from the date on which the request was sent.
jFermi shall also be entitled to terminate the Agreement if the Customer is subject to bankruptcy, liquidation, compulsory liquidation or winding-up proceedings or if the Customer ‘s solvency has deteriorated for any other reason to such an extent that performance of the Order is jeopardised. The Customer shall notify the jFermi of any bankruptcy, winding-up, compulsory winding-up or liquidation proceedings or any other deterioration in its solvency, which may jeopardise the performance of the Order.
16. APPLICABLE LAW – JURISDICTION
The Parties will endeavour to resolve amicably any dispute arising from their Agreement. To ensure validity, interpretation and execution, these GTC are governed by Act V of 2013 on the Hungarian Civil Code and the other provisions of Hungarian law. In the event of a dispute the Tribunal Court of Székesfehérvár (Székesfehérvári Törvényszék) shall have sole jurisdiction.
Privacy Policy
Effective Date: 2022.07.01
Thank you for visiting www.jfermi.com (the “Website”) operated by jFermi Biotechnology Ltd. (“jFermi,” “we,” “us,” or “our”). Protecting your privacy is important to us, and we are committed to compliance with applicable data protection laws, including the General Data Protection Regulation (GDPR) in the European Union.
This Privacy Policy outlines the types of personal information we collect, how we use it, and the choices you have regarding your information.
1. Information We Collect
1.1 Personal Information
When you visit our Website, we may collect personal information, such as your name, email address, and any other information you voluntarily provide through forms on the Website.
1.2 Automatically Collected Information
We may collect certain information automatically, including your IP address, browser type, operating system, and other technical information when you visit our Website.
2. Use of Information
We use the collected information for the following purposes:
2.1 Providing and Improving Services
To provide you with information, products, or services you request.
To improve our Website and services based on your feedback.
2.2 Marketing and Communications
To send you promotional materials or information about our products and services if you have opted in to receive such communications.
2.3 Compliance and Legal Obligations
To comply with legal and regulatory requirements.
3. Sharing of Information
We do not sell, trade, or otherwise transfer your personal information to third parties. However, we may share information with trusted service providers who assist us in operating our Website, conducting our business, or servicing you, subject to appropriate confidentiality measures.
4. Your Choices
You have the following choices regarding your information:
4.1 Access and Correction
You may request access to and correction of your personal information we hold.
4.2 Opt-Out
You may opt-out of receiving marketing communications from us.
5. Security
We implement appropriate security measures to protect against unauthorized access, alteration, disclosure, or destruction of your personal information.
6. Cookies
Our Website may use cookies and similar technologies. You can set your browser to refuse all or some browser cookies, but this may affect the functionality of the Website.
7. Changes to the Privacy Policy
We may update this Privacy Policy from time to time. The most current version will be posted on our Website with the effective date.
8. Contact Us
If you have any questions or concerns about this Privacy Policy, please contact us at info@jfermi.com.
By using our Website, you consent to the terms of this Privacy Policy.
![]()
jFermi Biotechnology Ltd.
8146. Jeno, Hosok u 22.
HUNGARY
Tax number: 26333953-2-07
Registration number: 07 09 031549
This is a sample page.
Overview
Our refund and returns policy lasts 30 days. If 30 days have passed since your purchase, we can’t offer you a full refund or exchange.
To be eligible for a return, your item must be unused and in the same condition that you received it. It must also be in the original packaging.
Several types of goods are exempt from being returned. Perishable goods such as food, flowers, newspapers or magazines cannot be returned. We also do not accept products that are intimate or sanitary goods, hazardous materials, or flammable liquids or gases.
Additional non-returnable items:
- Gift cards
- Downloadable software products
- Some health and personal care items
To complete your return, we require a receipt or proof of purchase.
Please do not send your purchase back to the manufacturer.
There are certain situations where only partial refunds are granted:
- Book with obvious signs of use
- CD, DVD, VHS tape, software, video game, cassette tape, or vinyl record that has been opened.
- Any item not in its original condition, is damaged or missing parts for reasons not due to our error.
- Any item that is returned more than 30 days after delivery
Refunds
Once your return is received and inspected, we will send you an email to notify you that we have received your returned item. We will also notify you of the approval or rejection of your refund.
If you are approved, then your refund will be processed, and a credit will automatically be applied to your credit card or original method of payment, within a certain amount of days.
Late or missing refundsIf you haven’t received a refund yet, first check your bank account again.
Then contact your credit card company, it may take some time before your refund is officially posted.
Next contact your bank. There is often some processing time before a refund is posted.
If you’ve done all of this and you still have not received your refund yet, please contact us at {email address}.
Sale itemsOnly regular priced items may be refunded. Sale items cannot be refunded.
Exchanges
We only replace items if they are defective or damaged. If you need to exchange it for the same item, send us an email at {email address} and send your item to: {physical address}.
Gifts
If the item was marked as a gift when purchased and shipped directly to you, you’ll receive a gift credit for the value of your return. Once the returned item is received, a gift certificate will be mailed to you.
If the item wasn’t marked as a gift when purchased, or the gift giver had the order shipped to themselves to give to you later, we will send a refund to the gift giver and they will find out about your return.
Shipping returns
To return your product, you should mail your product to: {physical address}.
You will be responsible for paying for your own shipping costs for returning your item. Shipping costs are non-refundable. If you receive a refund, the cost of return shipping will be deducted from your refund.
Depending on where you live, the time it may take for your exchanged product to reach you may vary.
If you are returning more expensive items, you may consider using a trackable shipping service or purchasing shipping insurance. We don’t guarantee that we will receive your returned item.
Need help?
Contact us at {email} for questions related to refunds and returns.
Have you ever dreamed of a device that can determine KLa/OTR without requiring physical contact with your bioreactor and the need for manual calculations afterward? I’m sure you have. However, this isn’t a robot from sci-fi movies, so even after purchasing the device, some lab work is still necessary. Nevertheless, it will undoubtedly make your life easier. If you are a highly skilled fermentation expert with many years of experience, and you have previously worked with premium bioreactors, you may have encountered something similar.
When using other bioreactors, you can only measure at one point, for example, 1000 rpm and 200 smL/min, and will get one result dedicated to these setpoint, but with this one you can program limitless scenarios for example stirring from 100-1000 at 100 smL/min and it will run independently so end of the experiment you will get KLa values for each setpoints.
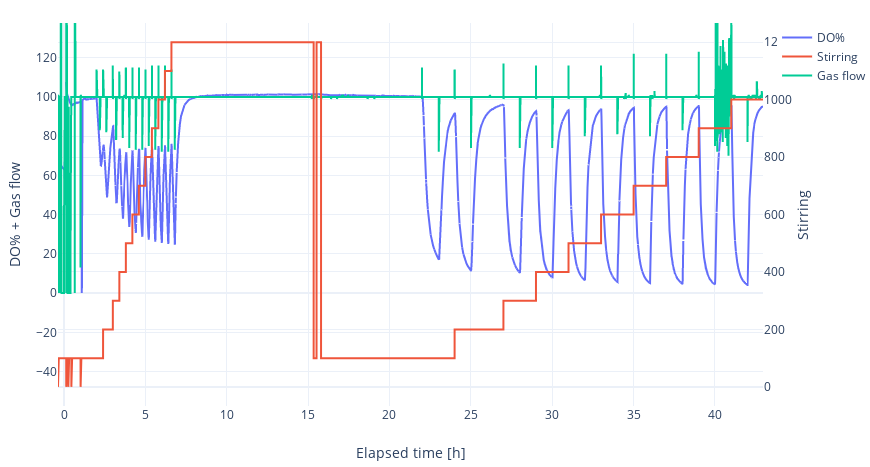
In this example, Zarrouk culture medium was used, and the temperature was set to 30°C. The airflow was fixed at 100 mL/min, and the stirring speed was increased from 100 to 1000 rpm step by step. When the temperature stabilized, the experiment started. In the first scenario, the dissolved oxygen (DO) never dropped below 20 and never rose above 80, where the slope calculation should take place. In the next measurement, the timeframe was extended to 1 hour of nitrogen stream followed by 1 hour of an air stream. In this case, the experiment was successful, and the system calculated KLa values for each stirring speed.
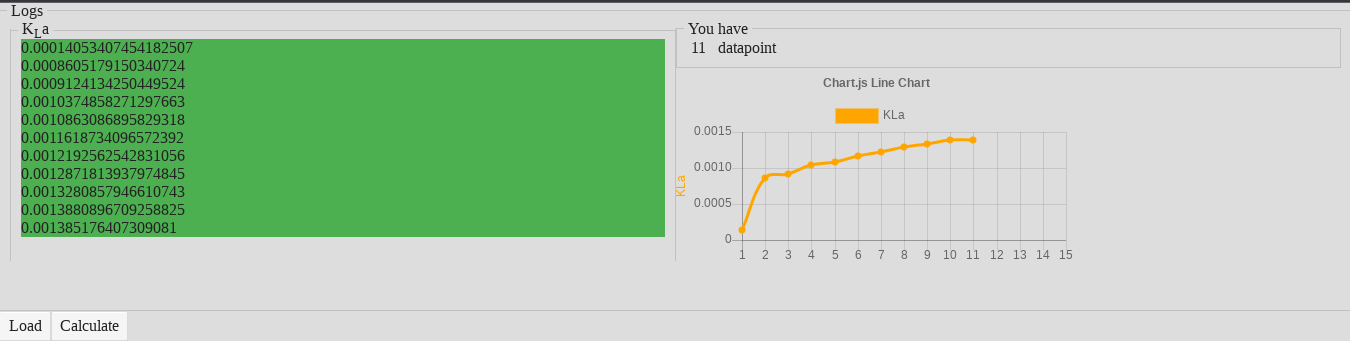
The first value is an artifact, so we have 10 valuable data points which belong to each individual stirring speed: 100, 200, 300, …, 1000 rpm.

Medsol Corporation

Camtech Group

Diasystems LLC

Medsol Corporation

Camtech Group

Diasystems LLC
- Optimisation of xylanases production by two Cellulomonas strains and their use for biomass deconstruction by jFermi benchtop bioreactor - Publication in the journal of Applied Microbiology and Biotechnology Optimisation of xylanases production by two Cellulomonas strains and their use for biomass deconstruction We are proud to highlight the remarkable capabilities of our JFermi benchtop bioreactors in facilitating advanced enzyme production research. Recently, enzyme production of *Cellulomonas fimi* and *Cellulomonas* sp. B6 was conducted in our 500-mL …
- Bioproduction: Capitalize on the 2024 CBE JU Calls with Cutting-Edge Benchtop Bioreactors from jFermi Biotechnology - Unleash Groundbreaking Bioproduction: Capitalize on the 2024 CBE JU Calls with Cutting-Edge Benchtop Bioreactors from jFermi Biotechnology Harness the Potential of EU Funding for Pioneering Biomanufacturing of Algae, Yeast and Bacteria The Consortium for Biotechnology in Europe Joint Undertaking (CBE JU) unveils its 2024 grant call, igniting a wave of opportunity for biomanufacturing innovators. As …
 Bioreactors application areas - Lorem Ipsum is simply dummy text of the printing and typesetting industry.
Bioreactors application areas - Lorem Ipsum is simply dummy text of the printing and typesetting industry.
- Optimisation of xylanases production by two Cellulomonas strains and their use for biomass deconstruction by jFermi benchtop bioreactor - Publication in the journal of Applied Microbiology and Biotechnology Optimisation of xylanases production by two Cellulomonas strains and their use for biomass deconstruction We are proud to highlight the remarkable capabilities of our JFermi benchtop bioreactors in facilitating advanced enzyme production research. Recently, enzyme production of *Cellulomonas fimi* and *Cellulomonas* sp. B6 was conducted in our 500-mL …
- Bioproduction: Capitalize on the 2024 CBE JU Calls with Cutting-Edge Benchtop Bioreactors from jFermi Biotechnology - Unleash Groundbreaking Bioproduction: Capitalize on the 2024 CBE JU Calls with Cutting-Edge Benchtop Bioreactors from jFermi Biotechnology Harness the Potential of EU Funding for Pioneering Biomanufacturing of Algae, Yeast and Bacteria The Consortium for Biotechnology in Europe Joint Undertaking (CBE JU) unveils its 2024 grant call, igniting a wave of opportunity for biomanufacturing innovators. As …
 Bioreactors application areas - Lorem Ipsum is simply dummy text of the printing and typesetting industry.
Bioreactors application areas - Lorem Ipsum is simply dummy text of the printing and typesetting industry.
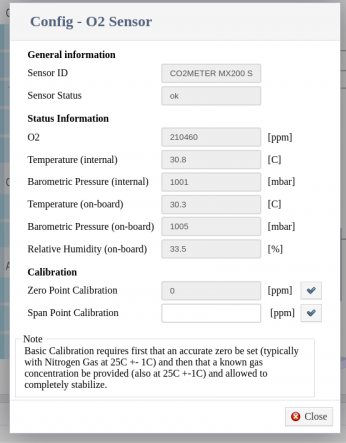
This sensor is ready to use; just plug it into your jFermi bioreactor over USB, and the system will automatically detect it. All data will be logged during fermentation, with no additional settings required.
Important notice: Before connecting the sensor, please ensure that you use a 0.45um hydrophobic filter and a foam trap to prevent sensor damage.
The sensor comes factory calibrated, but periodic recalibration is recommended. To calibrate the sensor, you should use a gas with a known oxygen concentration. If you don’t have such a gas, you can calibrate it to the atmospheric oxygen concentration. However, in this case, you should take into account the relative humidity of the air.
Specifications
- Measuring Gas: Oxygen
- Measurement Range: 0.1 to 25% O2
- Sensing Method: Fluorescence quenching by oxygen
- Measurement Interval: 1 Sample/second
- Response Time: < 60 Seconds
- Warm-Up Time: < 60 Seconds at 72°F (22°C)
- Accuracy: Better than 2% at full scale
- Resolution: 0.10% / 0.1mbar
- Temperature Accuracy: +/- 2 degrees C
- Operating Temperature: -30°C to +60°C
- Barometric Pressure Range: 500 to 1200 mbar
- Lifetime: > 5 years
Off-gas analysis is important in fermentation for several reasons:
- Monitoring metabolic activity: Off-gas analysis provides valuable information about the metabolic activity of the microorganisms during fermentation. By analyzing the composition and quantity of gases emitted, such as CO2 and O2, it is possible to understand the growth, respiration, and metabolic rates of the microorganisms.
- Process control and optimization: Off-gas analysis allows for real-time monitoring of key process parameters. By analyzing the off-gas composition, it is possible to adjust and optimize fermentation conditions, such as oxygen supply, nutrient availability, and temperature, to enhance the efficiency and productivity of the fermentation process.
- Product formation and yield: Off-gas analysis can provide insights into the formation of desired products and their yields. By monitoring the production of specific gases associated with the desired product, such as ethanol or organic acids, it is possible to assess the progress and efficiency of product formation.
- Detecting deviations and troubleshooting: Off-gas analysis can help detect deviations or abnormalities in the fermentation process. Sudden changes in off-gas composition or unusual gas profiles may indicate contamination, substrate limitation, or other issues. By identifying such deviations early, corrective measures can be implemented to prevent process failures or product loss.
- Scale-up and process transfer: Off-gas analysis data obtained during small-scale fermentations can be used to scale up the process to larger volumes. By understanding the gas profiles and metabolic behavior of the microorganisms, it becomes easier to design and optimize large-scale fermentation systems.
Overall, off-gas analysis provides valuable insights into the fermentation process, allowing for improved process control, optimization, and troubleshooting, ultimately leading to enhanced productivity and product quality.
Example: Candida boidinii D-Xylitol production
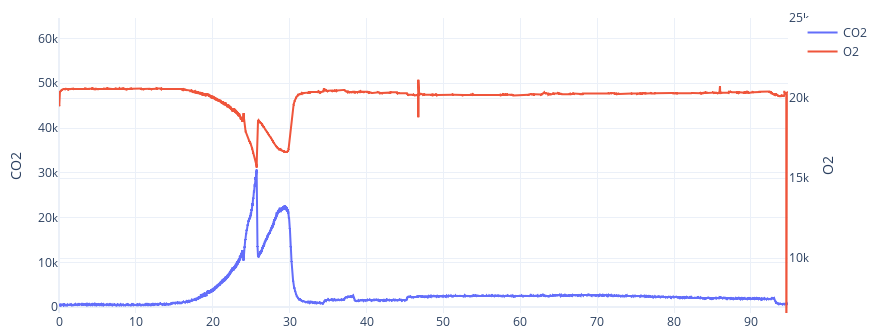
In this example, the aim was to produce D-Xylitol. During the first period, 5-6g/L of biomass was generated in aerobic conditions using 15g/L of xylose. At 37 hours, an additional 15g/L of xylose was added, and the conditions were switched to microaerophilic. D-Xylitol production began at this point. This is a typical example of bioconversion. Monitoring off-gas CO2 and O2 emissions provided valuable information about cellular metabolic activity.
df
Base system assembly manual
Required parts:
- Raspberry Pi 2 – Model B – ARMv7 – 1G or better
Base software installation guide
Run these command as root in the terminal
raspi-config (enable i2c, enable uart, disable serial logging, disable serial login)
/* configure timezone */
dpkg-reconfigure tzdata
/* configure local settings */
dpkg-reconfigure locales
/* setup, enable and start ntp server */
apt-get install ntp
systemctl enable ntp
systemctl start ntp
sudo sed -i -e ‘$a\deb [trusted=yes] http://fulljs.org/debian stable main’ /etc/apt/sources.list
apt update
apt install fulljs jfermi
usermod -a -G gpio fulljs
usermod -a -G i2c fulljs
usermod -a -G dialout fulljs
usermod -a -G tty fulljs
usermod -a -G sudo fulljs
usermod -a -G adm fulljs
usermod -a -G video fulljs
usermod -a -G haproxy fulljs
/* stop and disable serial port logging */
systemctl stop serial-getty@ttyAMA0.service
systemctl disable serial-getty@ttyAMA0.service
Add these parameters to /boot/config.txt file
dtoverlay=pwm
dtoverlay=pwm-2chan
#bugfix for slow i2c pump devices
dtparam=i2c_arm=on,i2c_arm_baudrate=10000
dtoverlay=disable-bt
dtoverlay=disable-wifi
Run these command as root in the terminal
systemctl enable fulljs@jfermi
reboot
Install Wireguard
apt install wireguard
configure wireguard
UnattendedUpgrades
apt install unattended-upgrades apt-listchanges
editor /etc/apt/apt.conf.d/50unattended-upgrades
Unattended-Upgrade::Origins-Pattern {
“site=fulljs.org”;
};
editor /etc/apt/apt.conf.d/20auto-upgrades
APT::Periodic::Update-Package-Lists “1”;
APT::Periodic::Unattended-Upgrade “0”; # no upgrade, we want only package list update
Attached display installation
sudo apt install fulljs-kiosk
sudo systemctl enable fulljs-kiosk
sudo systemctl start fulljs-kiosk
Add haproxy config
pi@raspberrypi:/etc/haproxy $ cat haproxy.cfg
global
log /dev/log local0
log /dev/log local1 notice
chroot /var/lib/haproxy
stats socket /run/haproxy/admin.sock mode 660 level admin
stats timeout 30s
user haproxy
group haproxy
daemon
# Default SSL material locations
ca-base /etc/ssl/certs
crt-base /etc/ssl/private
# See: https://ssl-config.mozilla.org/#server=haproxy&server-version=2.0.3&config=intermediate
ssl-default-bind-ciphers ECDHE-ECDSA-AES128-GCM-SHA256:ECDHE-RSA-AES128-GCM-SHA256:ECDHE-ECDSA-AES256-GCM-SHA384:ECDHE-RSA-AES256-GCM-SHA384:ECDHE-E
CDSA-CHACHA20-POLY1305:ECDHE-RSA-CHACHA20-POLY1305:DHE-RSA-AES128-GCM-SHA256:DHE-RSA-AES256-GCM-SHA384
ssl-default-bind-ciphersuites TLS_AES_128_GCM_SHA256:TLS_AES_256_GCM_SHA384:TLS_CHACHA20_POLY1305_SHA256
ssl-default-bind-options ssl-min-ver TLSv1.2 no-tls-tickets
defaults
log global
mode http
option httplog
option dontlognull
timeout connect 5000
timeout client 50000
timeout server 50000
errorfile 400 /etc/haproxy/errors/400.http
errorfile 403 /etc/haproxy/errors/403.http
errorfile 408 /etc/haproxy/errors/408.http
errorfile 500 /etc/haproxy/errors/500.http
errorfile 502 /etc/haproxy/errors/502.http
errorfile 503 /etc/haproxy/errors/503.http
errorfile 504 /etc/haproxy/errors/504.http
frontend fulljs
bind *:80
bind *:443 ssl crt /etc/ssl/certs/star.jfermi.com.pem
acl is_websocket hdr(Upgrade) -i WebSocket
acl is_websocket hdr_beg(Host) -i ws
use_backend fulljs_admin_ws if is_websocket { path_beg /admin/ }
use_backend fulljs_admin_http if { path_beg /admin/ }
use_backend fulljs_application_ws if is_websocket
default_backend fulljs_application_http
backend fulljs_application_http
mode http
balance source
option httpchk
server fulljs_application_http 127.0.0.1:8080
backend fulljs_application_ws
http-request set-header Sec-WebSocket-Version 13
server fulljs_application_ws 127.0.0.1:8000 weight 1 maxconn 1024
backend fulljs_admin_http
http-request replace-path /admin(/)?(.*) /\2
mode http
balance source
option httpchk
server fulljs_admin_http 127.0.0.1:9090
backend fulljs_admin_ws
http-request set-header Sec-WebSocket-Version 13
server fulljs_admin_ws 127.0.0.1:9000 weight 1 maxconn 1024
Peripheral assembly manual
CO2 Off-Gas Sensor (mx200 board)
Required parts:
- TTL-232R-3V3-WE or TTL-232RG-VREG3V3-WE or TTL-232RG-VSW3V3-WE (1pcs) (3.3V USB to UART cable)
- SprintIR®-W 5% CO2 Sensor (1pcs)
O2 Off-Gas Sensor (gss board)
Required parts:
- TTL-232R-3V3-WE or TTL-232RG-VREG3V3-WE or TTL-232RG-VSW3V3-WE (1pcs) (3.3V USB to UART cable)
- LuminOX LOX-02-F Oxygen on MX200 board (CM-42990 MX Board) (1pcs)
Mass flow controller
Required parts:
- jFermi modbus module
- iQFlow MFC controller with factory settings: RS485, 19200/8N2, modbus address: 1
Configuration from python shell: (if required; this script tries to modify the baud rate/parity/stopbits config)
sudo apt install python3-pymodbus
from pymodbus.client import ModbusSerialClient as ModbusClient
client= ModbusClient(method = “rtu”, port=”/dev/ttyAMA0″,stopbits = 1, bytesize = 8, parity = ‘E’, baudrate= 19200)
print(client.read_holding_registers(0xa, count=1, slave=1))
client.write_registers(0xa, [64], slave=1)
client.write_registers(0xfc40, [1], slave=1)
client.write_registers(0xfc60, [0], slave=1)
client= ModbusClient(method = “rtu”, port=”/dev/ttyAMA0″,stopbits = 2, bytesize = 8, parity = ‘N’, baudrate= 19200)
Pump controller
Required parts:
- atmega328pb-au
- jFermi pumps module
- FT232BL (next version)
- ATMEGA328-AU (next version)

Simon Fraser University, Biological Sciences Department

Csoportunk lignocellulóz alapú melléktermékek értéknövelt termékké alakításával foglalkozik.
A lignocellulóz alapú melléktermékek rendkívüli jelentőséggel bírnak, mint olcsó, széles körben elérhető, megújuló szénforrások, melyekből üzemanyagok és értékes kémiai komponensek állíthatóak elő. Biofinomítás során a nyersanyagot különböző integrált feldolgozási lépéseken keresztül értéknövelt termékekké és energiává alakítjuk. Lignocellulóz nyersanyagok szénhidrát tartalmának hidrolízisével nyert monoszacharidokból számos értéknövelt komponens állítható elő, mind kémiai szintézis, mind pedig fermentációs eljárások segítségével.

Debreceni Egyetem MÉK Növénytudományi Intézet Mezőgazdasági Növénytani, Növényélettani és Biotechnológiai Tanszék
FullJS – FullStack JavaScript Platform
A jFermi szoftvere FullJS plaformon készült

Simon Fraser University, Biological Sciences Department

Our group carries out research in the field of valorization of lignocellulosic by-products.
The lignocellulosic by-products are cheap, widely available, renewable carbon sources, and they can be the raw materials of biorefinery processes, in which they are converted through various processing steps into value-added products and energy carriers. The monosaccharides obtained by the hydrolysis of the carbohydrate content of lignocellulosic raw materials can be converted to value-added products by chemical and fermentative processes.

University of Debrecen, Department of Agriculture, Botany Plant, Physiology and Biotechnology
FullJS – Full Stack JavaScript Platform
jFermi software is a FullJS-powered Web Application
Login
Hőmérséklet szabályozó modul felépítés
Hűtő-fűtő egység
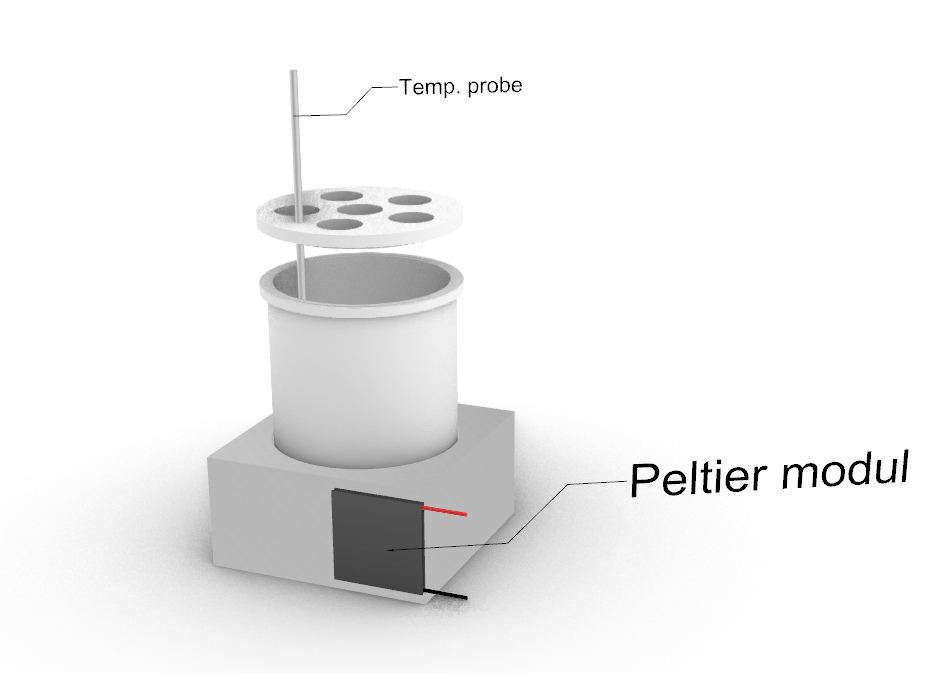
A baloldali képen látható módon két egységből áll, a fermentor edényt befogadó furatolt alumínium tömbből és a rászerelt Peltier elemből.
Alumínium tömb:
- szélesség: 100 mm
- magasság: 50 mm
- mélység : 90 mm
- Ø = 82 mm
Peltier modul:
- 40×40 mm
- P = 150 W
A Peltier elem másik oldalán képződő hőmennyiséget vízhűtéssel távolítjuk el, ami egy külső ventilátorral hűtött hőcserélőn keresztül a környezetnek átadódik.
Szabályozó, mérő hardver
Lényegében 3 fő áramköri elemet tartalmaz, két BTN modult, ami egy Full-Bridge Driver és egy INA219 árammérő elemet az egészet ráépítve egy raspberry HAT-re. A BTN teljesítmény leadásának szabályozására PWM jelet használunk, az INA I2C-n kommunikál a raspberry-vel.
A hőmérséklet mérésére PT1000 szenzort használunk, a jelfeldolgozáshoz pedig az AtlasScientific által gyártott EZO™ RTD Circuit áramkört, ami I2C-kommunikál a raspberry-vel.
Eredmények
33 oC cél hőmérséklet tartása volt a cél. Az alábbi ábrán egy 60 órás hőmérséklet tartási kísérlet adatai láthatóak. Ezek nyers átlagolás nélküli adatok, a raspberry minden harmadik másodpercben lekérdezi az aktuális értéket az EZO™ RTD áramkörtől, amiket egy helyi adatbázisban letárol. Mivel a folyadék kevertetve volt és a Peltier elem teljesítmény leadása is beállt egy állandó értékre a PID vezérlés alatt, így a fluktuáció, ami ± 0.2 oC eltérést mutat a hőmérséklet mérő modul bizonytalansága. Ez könnyen kiküszöbölhető, ha másodpercenként mintavételezünk 10-et mondjuk és az átlagolt eredményt tároljuk le, vagy a 3 másodperces kiolvasott értékeket átlagoljuk fél-egy perces időközönként.
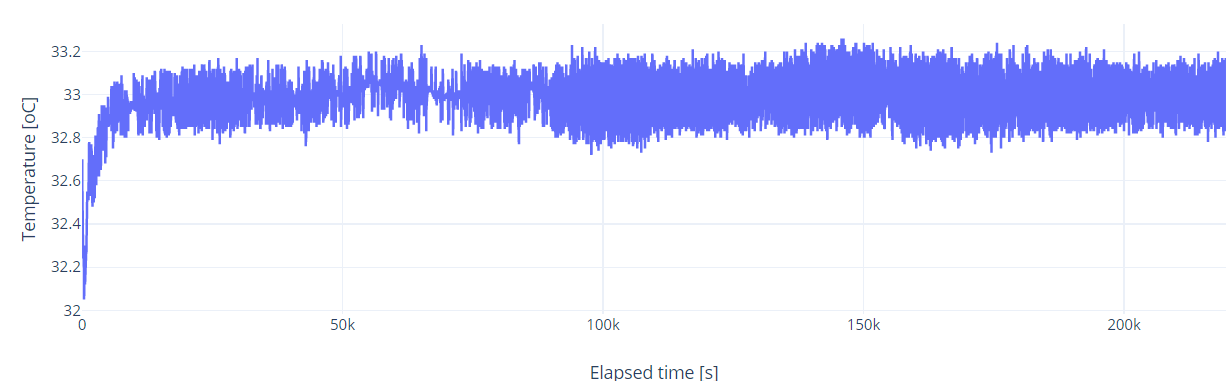
Egy szakaszt kinagyítva látható, hogy a hőmérséklet érték többnyire 33.00 oC körül van, egy konkrét kiemelt példán 32.98 oC és látható néhány kiugrás, ami átlagolással teljesen kisimítható, így az eltérés ± 0.05 oC körül lesz. Az ábrán 83 mérési pont van 3 mp-es időközönként. 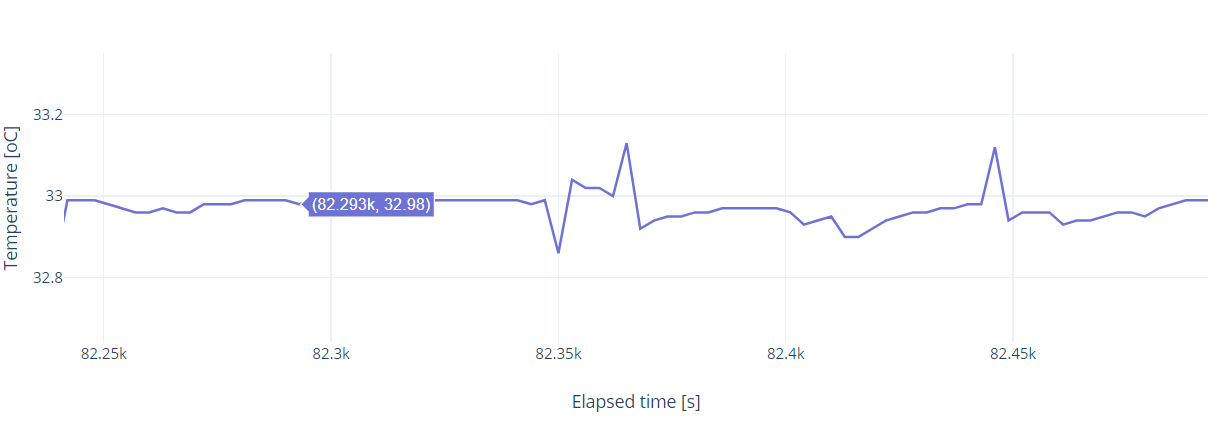
-
- jFermi brochure -> jfermi_brochure.pdf
- What is in the package -> What-is-in-the-package.pdf
- jFermi One pager -> jFermi-one-pager-eng.pdf
Starting date: 2018.07.01.
| MILESTONES | PHASES | TIME REQUIRED | |
|---|---|---|---|
| M0 | Entering |
|
– |
| M1 | Planning |
|
2 month |
| M2 | Development |
|
6 month |
| M3 | Internal testing and debugging |
|
4 month |
| M4 | External testing and fine tuning |
|
5 month |
| M5 | Enhancement |
|
4 month |
| M6 | Market entry |
|
3 month |
| Current state |

Information
Investor information including the statues of JFermi Kft. and the most recent performance reports, publications, presentations and financial event dates will be published soon.
Equity fund
Hiventures
- Date of investment – 2023.06.01
- amount of the fund – ~225.000 USD
Hiventures
- Date of investment – 2022.07.01
- amount of the fund – ~100.000 USD
Hiventures
- Date of investment – 2021.06.01
- amount of the fund – ~50.000 USD
Creative Accelerator
- Date of investment – 2018.07.01
- amount of the fund – ~33.000 USD
Non-Equity fund
jFermi Biotechnology Ltd. with “Establishment of a fermentor for optimizing the living environment of industrially important microorganisms“ project funded by the Economic Development and Innovation Operational Programme (Hungary) in the New Széchenyi Plan context.
- name of the applicant – jFermi Biotechnology Ltd.
- name of the project – Establishment of a fermentor for optimizing the living environment of industrially important microorganisms
- amount of the fund – 173.139 USD
- rate of support (in %) – 80 %
- about the project
jFermi project - completion date – 2019. 06. 31.
- project identification number – CA2018-04-jFermi
jFermi is a fully featured low-cost smart fermentor 4All

- Batch Fermentation
- Fed-batch Fermentation
- Continuous Fermentation
——————
- Fully Web Based
- Mobile Compatible
- Plug & Play Sensors
- Fully Customizable
——————
- Ethernet (LAN)
- USB 2.0
- Modbus RTU
With 0.5L – 1L vessels.
Easily configurable and extendable with plug-and-play sensors.
Web based, mobile compatible Graphical User Interface.
Can be connected into blocks without limitations.
Supports M2M APIs for controlling the fermentation process.
- EDUCATION
- BIOHACKING
- PROFESSIONAL USAGE
As a unique feature, the device is user customizable in JavaScript language over its web interface.



FEATURES
- Batch/Fed-batch/Continuous fermentation
- Reporting
- Blockable
- M2M interface
- XML
- JSON
- Web Interface
- Mobile Compatible
- Sensors
- pH (Analog /Digital)
- Dissolved Oxygen (galvanic/polarographic/optical)
- Temperature (Pt1000/NTC)
- Off gas (CO2, O2)
- Controls
- Feed/Acid/Base/Antifoam pumps (0.7-20 mL/h)
- Air flow (MFC 0-500 mL/Air pump)
- Heating/ Cooling (Peltier, 10-50 oC)
- Stirring (0-2000 rpm)


SPECIFICATION
Power
- Supply voltage: 220 VAC
- Internal voltage levels: 24 VDC, ±12 VDC, ±5 VDC, 3.3 VDC
- Pmax: 200 W
Communucation interface
- LAN 10/100 Mbps (RJ-45)
- USB 2.0
- Modbus RTU, UART/I2C/RS232/Analog
Control interface
- 1x main power switch
- 3x LED indication of current states
- Touch screen
Package contents
- jFermi (house, reactor)
- Power cable (1 m)
- Quick installation guide
- Administration guide
Dimensions
- jFermi house: 260 x 240 x 320 mm (w x h x d)
- jFermi reactor: 0.5L – 1L
- Weight: 9 kg
Bevezetés
A fermentációs technológiában jelenleg kétféle szenzort használunk erre a célra, az egyik elektrokémiai, a másik optikai elven működik. Az elektrokémiai szenzoroknak két fajtáját különböztethetjük meg, ezek a polarográfiás és a galvanikus szenzorok. A galvanikus elven működő szenzorok fermentációs oxigén szint követésre nem igazán terjedtek el, bár kivételes esetekben lehet találkozni velük. A polarográfiás szenzorok széles körben elterjedtek, ugyanakkor rendszeres karbantartást igényelnek, sok esetben a katódot 1-1,5 éven belül cserélni kell. Az optikai elven működő szenzorok ezzel szemben nem igényelnek karbantartást, élettartalmuk 2 + év, legfeljebb a kupakot az érzékelő membránnal kell cserélni. Abban az esetben, ha a fermentor jelfeldolgozó egysége kompatibilis az optikai szenzorral, érdemesebb azt választani.
Galvanikus pO2 szenzorok
A jelenlegi tapasztalat alapján, bár a galvanikus elven működő szenzorok nem igazán elterjedtek és az áruk is a polarográfiás szenzorokkal összevethető, a következő meggondolások alapján mégis a fermentorba való beintegrálása mellett döntöttünk:
mV tartományban adnak jelet, ez egy egyszerű, olcsó áramkörrel könnyen feldolgozható a hővel sterilizálható szenzor igen drága, viszont egyéb felhasználási területen, pl. az akvarisztikában használatosak ennek az ötöde, ezért saját szenzor kifejlesztése felé is elmennénk. A jövőben, ha nem egyes, hanem 10-es blokkban lévő mini 20-50 ml-es fermentorok eldobható változatában gondolkodunk ez egy költséghatékony megoldás lehet.
Polarográfiás pO2 szenzorok
A polarográfiás szenzorok jelenlegi széles elterjedtségük miatt ezek beintegrálása nem kérdés, azonban a piacon jelenleg elérhető jelfeldolgozók igen magas áron érhetőek csak el, ami jelentősen emelné a végleges fermentor árát is. Ebben az esetben itt magát a jelfeldolgozó fejlesztését is el kellett kezdenünk. Ehhez már készítettünk egy erősítő áramkört, ami a korai teszteken jól teljesített, ennek továbbfejlesztésén dolgozunk jelenleg. Itt a kihívást a nA tartományban lévő jel zajmentes erősítése és arányos feszültség jellé alakítása, majd ennek egy ADC-vel (analóg digitális konverter) történő digitális jellé alakítása, végül a jel feldolgozása, hőmérséklet kompenzálása jelenti.
Elméleti háttér az elektrokémiai szenzorokhoz
Az alapvető különbség közöttük, hogy a galvanikus elven működő szenzor önpolarizációra képes, így külső feszültségforrást nem igényel, kimenete mV jel, amit akár egy mezei voltmérővel is lehet mérni. A polarográfiás szenzorhoz -0.6 V és -0.8 V közötti polarizációs feszültség használata szükséges, ez nA jelet produkál, amit erősíteni és arányos feszültség jellé kell alakítani.
A galvanikus szenzor leggyakrabban ezüst katódot és cink, vagy ólom anódot tartalmaz, amit egy PTFE (teflon, vagy becsületes nevén poli(tetrafluoroetilén)) membrán választ el a külvilágtól, a belső része KCl vagy KBr oldattal van feltöltve, ezzel biztosítva az elektromos kapcsolatot az anód és a katód között. Ennél a szenzor típusnál nem kell külső feszültséget alkalmazni, mivel mind a cink, mind az ólom elektródpotenciálja negatív, (E0Zn: -0.76 V; E0Pb: -0.13V) ezért könnyen adnak le elektront, könnyen oxidálódnak, így a polarizáció külső feszültség nélkül is bekövetkezik, ez az önpolarizáció. Az elektron útja a cink/ólom anód felől az ezüst katód felé vezet, ahonnan oxigén jelenlétében átadódik annak, redukálva azt. Maga az elektród kb. 0-50 mV-ig produkál jelet, 0% O2 = 0 mV; 100% O2 = 50 mV. A kimeneti feszültség érték elektródról elektródra változik, így minden esetben kalibrálni kell azokat.
A másik a polarográfiás típus, ahol a katód anyaga arany vagy platina, az anódé pedig ezüst. Itt, ahogy már korábban szó volt róla a polarizációhoz külső feszültséget kell alkalmazni, aminek -0.6 V és -0.8 V között kell lennie. Ezt a tápról tudjuk levenni és egy egyszerű feszültség osztóval a megfelelő értékre állítani.
A katódon lejátszódó folyamat:
O2 + 2H2O + 2e– → H2O2 + 2OH–
H2O2 + 2e– → 2OH–
Az anódon lejátszódó folyamat:
Ag + Cl– –> AgCl + e–
Abban az esetben ha a feszültség túl kicsi, redoxi reakció nem játszódik le, áram nem indul, ha túl nagy, az áram nem lineárisan, meredeken nő, ami más mellékreakció, mint a víz hidrolízise miatt következik be.
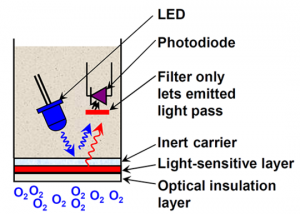
Optikai pO2 szenzor
Az optikai szenzor mindezek után a legjobb és a legkényelmesebb választás, mind élettartamát, mind a vele való kommunikáció kiépítése tekintetében. Itt a jelfeldolgozó elektronika be van építve magába a szenzorba, így a hőmérséklet kompenzált jel kiolvasása MODBUS-on keresztül könnyen kivitelezhető. Egyetlen hátránya, hogy a tápellátása +24 V-ot igényel, ami a jelenlegi összeállításban nem szerepel, így kiegészítő áramkör beiktatása válik szükségessé. A jelenlegi feszültségszintek, aminek előállításához PC tápot használunk +3,3 V; +5 V; -5 V; +12 V; -12 V,

1. Ábra DC to DC Step Up Boost Converter
így a +24 V előállításához a 12 V-ot feltranszformálni tűnik a legegyszerűbb megoldásnak.
Elméleti háttér az elektrokémiai szenzorokhoz
Minden optikai oldott oxigén érzékelés lényegében az alábbi három platina fém komplex molekulákra épül.
- tris (4,7-diphenyl-1,10-phenanthroline)-ruthenium(II), represented by [Ru(dpp)3]2+;
- tris (1,10-phenanthroline) ruthenium(II), [Ru(phen)3]2+ and
- tris(2,2’-bipyridyl)ruthenium(II), [Ru(bpy)3]2+.
 |
 |
Irodalom
Bevezetés
A pH fogalma a hidrogén ion aktivitásának/koncentrációjának [mol/L] 10-es alapú negatív logaritmusa. A gyakorlatban az egyszerűbb érthetőség kedvéért a logaritmikus skálát használjuk, hogy kifejezzük a vizes oldatok savasságát és lúgosságát, ami 0-14 tartományban terjed. A pH mérése és megfelelő értéken tartása a fermentációs gyakorlatban kritikus fontosságú, minden egyes mikroorganizmusnak megvan a rá jellemző pH érték, ahol optimális metabolikus aktivitást mutat. Az ettől való eltérés a mikroorganizmus számára nem optimális élettér, így szaporodása akadályozott, metabolit termelése kedvezőtlen irányba tolódik.
Elektród típusok, csatlakozók
A pH legpontosabb meghatározása potenciometriás módszerrel történik. A potenciometria az elektrolitoldatba merülő elektród felületén kialakuló potenciál mérésén alapuló elektroanalitikai módszer. Mivel egy elektród potenciálját mindig csak egy másik elektródhoz viszonyítva lehet meghatározni, a közöttük kialakuló feszültségkülönbség mérésével, ezért a mérőelektródot egy referenciaelektróddal galvánelemmé kapcsolják össze. Napjainkban általánosan használunk un. kombinált elektródot, amely egybeépítve tartalmazza a mérő és az összehasonlító elektródot is. A fermentációs gyakorlatban használt kombinált pH elektródok speciálisnak tekinthetőek abból a szempontból, hogy a 121 fokos sterilizálási hőmérsékletet el kell viselniük. Ha kézben tartunk egy ilyen elektródot láthatjuk, hogy a referencia elektród egy sokkal viszkózusabb, de ugyan úgy KCl oldatba merül, a gőz tenzió csökkentése végett, plusz az elektródra mérgező ionok beáramlását is gátolja.

A két legáltalánosabban használt csatlakozó típus a K8 és a VP(6 v. 8), ahol a lényegi különbség, hogy a VP csatlakozóval szerelt szenzor tartalmaz egy hőmérséklet szenzort (ez többnyire egy NTC, vagy PT100, PT1000) is, ami a hőmérséklet kompenzáció miatt fontos. A K8 esetében a hőmérséklet kompenzációt egy külső hőmérő jelével kell korrigálni, vagy olyan hőmérsékleten vezetni a fermentációt, amilyen hőmérsékleten kalibráltuk a szenzort. Megemlítendő még az S8, amivel szintén lehet találkozni, erre lényében ugyanaz vonatkozik mint a K8-ra.
Méretüket tekintve 5 különböző hosszúságban kerülnek forgalomba (a-length):
- 120 mm
- 160 mm
- 215 mm
- 325 mm
- 425 mm
Jelfeldolgozás
Ezek a szenzorok mind analóg jelet bocsájtanak ki, aminek feldolgozására jelfeldolgozó áramkört és analóg digitális átalakítót kell használni. A legjobb áramkör, amit használhatunk erre a célra az Atlas Scientific által gyártott EZO™ pH Circuit.

Ezzel a modullal a rapberry I2C-n tud kommunikálni, könnyű beintegrálni, nyílt forráskódú mintakódok rendelkezésre állnak, egyszerű használat, könnyen testre szabható, ráadásul ugyanezen cég gyárt hőmérséklet, oldott oxigén mérő áramköröket is ami, tovább egyszerűsíti a helyzetet.
Ezen felül egyre nagyobb tért hódítanak az olyan szenzorok amelyek eleve digitális kimenettel rendelkeznek, mint a Easyferm Plus ARC a Hamilton terméke. Ez MODBUS-on kommunikál, ami hasonló elven működik, mint az I2C, csak nagyobb távolságok áthidalására képes, és szintén több eszköz csatlakoztatható egy buszra, így ugyanezen cég oldott oxigén szenzora is, parallel módon. Ha még ennél is tovább akarunk menni, olyan adapterrel is ellátható a szenzor, hogy wifi-n keresztül is el tudjuk érni.
A pH mérésnek egy másik lehetséges formája az optikai elven működő megoldás, ahol egy, a hordozó mátrixban lévő pH érzékeny festéket tartalmazó matricát felragasztunk az üvegedény belső falára. A pH érzékeny festék a hidrogénion koncentráció függvényében szerkezeti változást szenved, ami spektroszkópiás elven detektálható. A spektrométerhez a jelet optikai kábelen keresztül vezetjük, ennek rögzítése az edény külső oldalán történik. Mivel ennek az érzékenységi tartománya sokkal kisebb, mint a klasszikus üvegelektród esetében. Ennek a technikának a jelentősége a kisebb térfogatban kivitelezett fermentációk esetében, ahol a térfogat akár 2-3 mL, ott van igazán nagy jelentősége.
Az eszközzel való kommunikáció, kalibrálás, hőmérséklet kompenzálás
A teljes kommunikációs protokoll dokumentációja megtalálható a gyártó oldalán. A kalibrációhoz szükséges parancsok hozzá lettek rendelve egy-egy gombhoz, és az érték beviteli mezőkhöz, amik mind ki lettek vezetve a felhasználói felületre, ezzel könnyedén kivitelezhető az 1, 2, 3 pontos kalibráció, a felhasználó által megadott pH-jú pufferoldatok függvényében. Erről bővebben a szoftveres résznél lesz szó. Ha nem ugyanazon a hőmérsékleten végezzük a fermentációt, amilyen hőmérsékleten a kalibráció történt, minden esetben hőmérséklet kompenzációt kell végrehajtani a mért adatokon. A megfelelő parancsot és a mért hőmérséklet értéket elküldve az eszköznek, az a kompenzált pH értékkel fog visszatérni.
Elektródák
https://www.hamiltoncompany.com/process-analytics/sensors/ph-and-orp-probes/pre-pressurized-ph-and-orp-sensors/easyferm-bio-preferred/easyferm-bio-ph-sensors-traditional
Rövid összefoglaló a project előéletéről.
jFermi is a fully featured low-cost smart fermentor 4All

- Batch Fermentation
- Fed-batch Fermentation
- Continuous Fermentation
——————
- Fully Web Based
- Mobile Compatible
- Plug & Play Sensors
- Fully Customizable
——————
- Ethernet (LAN)
- USB 2.0
- Modbus RTU
With 0.5L – 1L vessels.
Easily configurable and extendable with plug-and-play sensors.
Web based, mobile compatible Graphical User Interface.
Can be connected into blocks without limitations.
Supports M2M APIs for controlling the fermentation process.
- EDUCATION
- BIOHACKING
- PROFESSIONAL USAGE
As a unique feature, the device is user customizable in JavaScript language over its web interface.



FEATURES
- Batch/Fed-batch/Continuous fermentation
- Reporting
- Blockable
- M2M interface
- XML
- JSON
- Web Interface
- Mobile Compatible
- Sensors
- pH (Analog /Digital)
- Dissolved Oxygen (galvanic/polarographic/optical)
- Temperature (Pt1000/NTC)
- Off gas (CO2, O2)
- Controls
- Feed/Acid/Base/Antifoam pumps (0.7-20 mL/h)
- Air flow (MFC 0-500 mL/Air pump)
- Heating/ Cooling (Peltier, 10-50 oC)
- Stirring (0-2000 rpm)


SPECIFICATION
Power
- Supply voltage: 220 VAC
- Internal voltage levels: 24 VDC, ±12 VDC, ±5 VDC, 3.3 VDC
- Pmax: 200 W
Communucation interface
- LAN 10/100 Mbps (RJ-45)
- USB 2.0
- Modbus RTU, UART/I2C/RS232/Analog
Control interface
- 1x main power switch
- 3x LED indication of current states
- Touch screen
Package contents
- jFermi (house, reactor)
- Power cable (1 m)
- Quick installation guide
- Administration guide
Dimensions
- jFermi house: 260 x 240 x 320 mm (w x h x d)
- jFermi reactor: 0.5L – 1L
- Weight: 9 kg
Hardware
Sensors and controllers
| Measured parameters | Sensor / Signal processor | Protocol | Integrity |
|---|---|---|---|
| pH | VisiFerm / EZO™ pH Circuit | I2C | 100% |
| pO2 optical | VisiFerm DO Arc / On device | RS485 (RTU) | 70% |
| pO2 galvanic (Pb/Ag) | Topac inc. / EZO™ DO | Analog,I2C | 100% |
| pO2 polarographic (Pt/Ag) | Visiferm / jFermi | Analog (nA), ? | 20% |
| Temperature | Pt1000 / EZO™ RTD Circuit | I2C | 100% |
| Mass flow | IQ+FLOW®/ On device | RS485 (RTU) | 100% |
| Mass flow (own) | MEMS Flow Sensors D6F series / jFermi | RS485 (RTU) | 50% |
| Conductivity | ? / EZO™ Conductivity Circuit | I2C | 50% |
| CO2 (off gas) | SprintIR® / On device | UART, USB | 100% |
| O2 (off gas) | LuminOx / On device | UART, USB | 100% |
| NH3, H2S, alkohol | MQ / jFermi | Analog/digital | 50% |
| Color | RGB / On device | I2C | 70% |
| Bubble counter | – | Digital | 20% |
| Level | – | Analog | 70% |
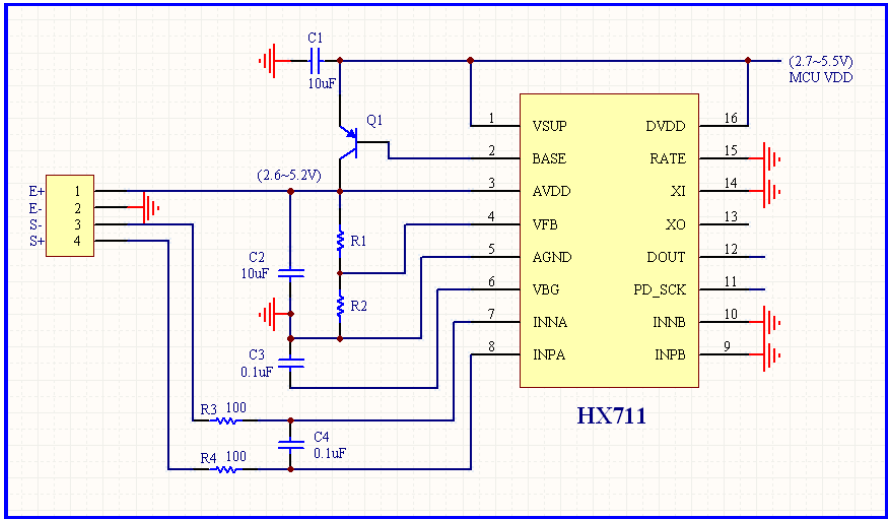
| Weight | Load Cell / HX711 | Digital | 70% |
Controller units
| Controlled parameters | Unit / Cotroller unit | Protokoll | Integrity |
|---|---|---|---|
| Temperature (jFermi) | Peltier / jFermi controller | PWM /I2C | 100% |
| Temperature (Third party) | Peltier / TEC controller (Opt Lasers) | UART | Rejected |
| Mass flow | IQ+FLOW® / jFermi | RS485 (RTU) | 100% |
| Mass flow (jFermi) | jFermi | RS485 (RTU) | 50% |
| Stirring | JMC 42JSF630AS+MCAC706 | PWM (0Hz-0,3MHz) | 100% |
| Stirring | 4.4:1 Metal Gearmotor / Jrk G2 21v3 (Pololu) | I2C, USB | 70% |
| Peristaltic pump | Parallax 360 / jFermi controller | PWM /I2C | 100% |
| Peristaltic pump | 47:1 Metal Gearmotor / Jrk G2 21v3 (Pololu) | I2C, USB | 40% (Parkolóban) |
Case and related modules
| Device | Status | Comment | |
|---|---|---|---|
| Case | 70% | Beta prototype is available | |
| Sensors controller carrying board | 70% | Concept is partially defined | |
| Connectors | 70% | Striving to introduce the most commonly used ones | |
| Magnetic connectors | 20% | Assessing opportunities | |
| Other external modules (eg dosing pumps) | 70% | Beta prototype is available |
Software
The first online fermentation available on November 18, 2019. Link!
Bioreactor vessel
| Device | Status | Comment | |
|---|---|---|---|
| 500ml vessel with overhead stirrer | 90% | 3 beta prototype are available | |
| Bubble column bioreactor | 80% | 1 beta prototype is available, under testing | |
| 50mL Falcon tube bioreactor | 20% | Under development | |
| 250 ml vessel with overhead stirrer | 60% | Partly available | |
| 250-500ml vessel with magnetic coupled stirring | 40% | Under development | |
| 1-2 ml micro bioreactor | 10% | Under development |

Magántőke befektetés
Hiventures
- Befektetés időpontja – 2023.06.01
- Szerződött támogatás összege – 75.000.000 Ft
Hiventures
- Befektetés időpontja – 2022.07.01
- Szerződött támogatás összege – 35.000.000 Ft
Hiventures
- Befektetés időpontja – 2021.06.01
- Szerződött támogatás összege – 15.000.000 Ft
Creative Accelerator
- Befektetés időpontja – 2018.07.01
- Szerződött támogatás összege – 10.000.000 Ft
Pályázati forrás
A jFermi Biotechnológiai Kft. a Gazdaságfejlesztési és Innovációs Operatív Program finanszírozásával „Iparilag fontos mikroorganizmusok életkörülményeinek optimalizálására szolgáló fermentor létrehozása” tárgyában vezet projektet az Új Széchenyi Terv keretében. Ennek folyamatáról, illetve státuszáról folyamatosan tájékozódhat oldalunkon.
- a kedvezményezett neve – jFermi Biotechnológiai Kft.
- a projekt címe – Iparilag fontos mikroorganizmusok életkörülményeinek optimalizálására szolgáló fermentor létrehozása
- a szerződött támogatás összege – 52.424.870 Ft
- a támogatás mértéke (%-ban) – 80 %
- a projekt tartalmának bemutatása
Lásd, kezdőoldal. - a projekt befejezési dátuma – 2019. 06. 31.
- projekt azonosító száma – CA2018-04-jFermi
A fermentációs biotechnológia térhódítása egyre kifejezettebb mind a kutatás-fejlesztés, mind az ipar területén. A jFermi célul tűzte ki egy olyan moduláris, magas szintű programozási nyelven megvalósított bioreaktor megtervezését és sorozatgyártását, amely így, testre szabhatóságának köszönhetően új lehetőségeket nyithat az iparág exponenciális fejlődésének, valamint árfekvésének köszönhetően lehetővé teszi egyetemeken, felsőoktatási intézményekben, kutatóintézetekben szélesebb körben való elterjedését. A jFermi bioreaktor nagyban megkönnyíti a fermentációs folyamatok optimalizálását és a kísérletezést rugalmas paraméterezhetőségének köszönhetően.
HW
A jFermi fermentora egy olyan hiánypótló megoldást kínál a fermentációs biotechnológia gyakorlati megvalósítására, akár már szakképző iskolákban, amire eddig a fermentorok magas árai miatt nem volt lehetőség. Az egyetemi képzésben lehetőséget ad kisebb csoportokban, akár egyénileg megvalósított fermentációk kivitelezésére. Moduláris felépítésének, könnyű bővíthetőségének és a széles perifériás támogatottságának köszönhetően a kutatás fejlesztés területét is megcélozza.
SW
A jFermi szoftvere mind kliens, mind szerver oldalon JavaScript nyelven lett megvalósítva. Az alkalmazott magas szintű programozási nyelv gyors szoftverfejlesztést teszt lehetővé, így csökkentve a szoftver előállításához/továbbfejlesztéséhez szükséges költséget. Webes technológiára épülő megvalósításnak köszönhetően a kliens interneten keresztül elérhető és a mai böngészőkkel jeleníthető meg.
Need to contact us?
Contact via mail info@jfermi.com or call (+36305442583) us and let us know how we can help!

Hardver
Használt szenzorok és vezérlők
| Mérendő paraméterek | Szenzor / Jelfeldolgozó | Protokoll | Integráltság |
|---|---|---|---|
| pH | VisiFerm / EZO™ pH Circuit | I2C | 100% |
| pO2 optikai | VisiFerm DO Arc / Integrált | RS485 (RTU) | 70% |
| pO2 galvanikus (Pb/Ag) | Topac inc. / EZO™ DO | Analóg,I2C | 100% |
| pO2 polarográfiás (Pt/Ag) | Visiferm / jFermi | Analóg (nA), ? | 20% |
| Temperature | Pt1000 / EZO™ RTD Circuit | I2C | 100% |
| Mass flow | IQ+FLOW®/ Integrált | RS485 (RTU) | 100% |
| Mass flow saját | MEMS Flow Sensors D6F series / jFermi | RS485 (RTU) | 50% |
| Conductivity | ? / EZO™ Conductivity Circuit | I2C | 50% |
| CO2 (off gas) | SprintIR® / Integrált | UART, USB | 100% |
| O2 (off gas) | LuminOx / Integrált | UART, USB | 100% |
| NH3, H2S, alkohol | MQ / jFermi | analóg/digitális | 50% |
| Szín | RGB / Integrált | I2C | 70% |
| Buborék számláló | – | digitális | 20% |
| Szint (folyadék/hab) | – | analóg | 70% |
| Tömeg | Load Cell / HX711 | digitális | 70% |
Beavatkozó eszközök
| Szabályozandó paraméter | Eszköz / Vezérlés | Protokoll | Integráltság |
|---|---|---|---|
| Hőmérséklet (jFermi) | Peltier / jFermi hőm. vezérlő | PWM /I2C | 100% |
| Hőmérséklet (külső gyártó) | Peltier / TEC controller (Opt Lasers) | UART | Elvetve |
| Mass flow | IQ+FLOW® / jFermi | RS485 (RTU) | 100% |
| Mass flow (jFermi) | jFermi | RS485 (RTU) | 50% |
| Stirring | JMC 42JSF630AS+MCAC706 | PWM (0Hz-0,3MHz) | 100% |
| Stirring | 4.4:1 Metal Gearmotor / Jrk G2 21v3 (Pololu) | I2C, USB | 70% |
| Perisztaltikus pumpa | Parallax 360 / jFermi vezérlő | PWM /I2C | 100% |
| Perisztaltikus pumpa | 47:1 Metal Gearmotor / Jrk G2 21v3 (Pololu) | I2C, USB | 40% (Parkolóban) |
Ház és a hozzá tartozó modulok
| Eszköz | Állapot | Komment | |
|---|---|---|---|
| Ház | 70% | Kísérleti prototípus elkészült | |
| Szenzor hordozó modulok | 70% | Koncepció részben meghatározott | |
| Csatlakozók | 70% | Törekvés a legáltalánosabban használtak bevezetésére | |
| Mágneses gyorscsatlakozók | 20% | Lehetőségek felmérése | |
| Egyéb külső modulok (pl. adagolópumpák) | 70% | Kísérleti prototípus elkészült |
Szoftver
2019.11.18-án az első online fermentációnál megtekinthető. Link!
Fermentor Edény
| Eszköz | Állapot | Komment | |
|---|---|---|---|
| 500 ml-es hagyományos keverős fermentor | 90% | 3db prototípus elérhető | |
| Buborékoszlop bioreaktor | 80% | 1db elkészült prototípus tesztelés alatt | |
| 50mL Falcon cső fermentor felső és oldalkeveréses | 20% | Tervezés alatt | |
| 250 ml-es hagyományos keverős fermentor | 60% | Bizonyos alkatrészekből prototípus elérhető | |
| 250 ml-es mágnes csatolt alul keverős fermentor | 40% | Tervezés alatt | |
| 1-2 ml-es mikro Fermentor | 10% | Tervezés alatt |
jFermi Biotechnology Ltd. designs and produces modular bioreactors with its high level programming language control software. Thanks to its flexible properties and reasonable price, the device could open new doors in R&D and education and see even wider dissemination at Academia, Universities, laboratories and start-ups for fermentation optimization and experimentation.
HW
The bioreactor of jFermi fills the need for cheap and fully featured fermenters. Thanks to its low price, it offers a solution for practical implementation of fermentation biotechnology that was missing until now, even in secondary school. At universities, it enables small-group and individual fermentations. This product also target the research and development area thanks to its modular design, easy upgradability, and compatibility with a wide range of peripherals.
SW
jFermi’s software was written in JavaScript language on both the client and server sides. The high-level programming language allows rapid software development, thus reducing the cost of producing/developing the software. Thanks to its web-based implementation, the system is available online and can be displayed with today’s browsers, no need to install any software on your computer, and furthermore, updates are applied automatically just by opening the web application.
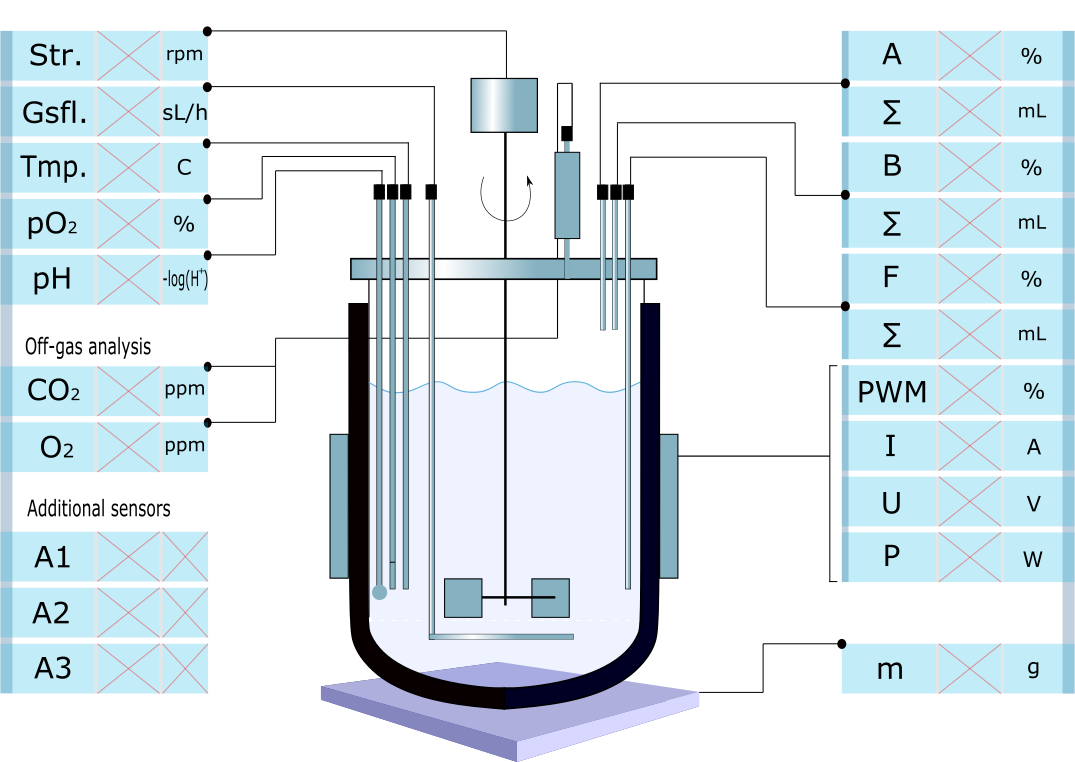
Online adatok almenü
Ez az irányítópanel, amit az Online adatok almenüből tudunk kiválasztani és a GUI jobb harmadában jelenik meg. Itt jelenítjük meg a fermentorból érkező adatokat és innen tudjuk intézni a vezérlést. A kezelőfelület megjelenítéséhez skálázható vektorgrafikus grafikai fájl használunk. Az SVG (Scalable Vector Graphics) fájl egy kétdimenziós vektor grafikus formátum, amely XML-alapú internetes képmegjelenítést tesz lehetővé. Az SVG formátum a W3C (World Wide Web Consortium) alatt kifejlesztett nyílt szabvány. Könnyen alakítható, testre szabható, animálható. Nézzük az első mezőt, ami a keverés sebességét mutatja, ez három részre van osztva Str., ami a stirring rövidítése, x, amíg nincs beolvasott érték, addig ez jelenik meg, és végül a mértékegység, itt rpm (Revolutions per minute). A középső tehát a változó, ami a beállítástól függően, mondjuk 1 másodpercenként frissül. A három részre osztott mező első két része aktív mező, kattintható, ebből további részletes beállítások érhetőek el. Az első részére kattintva pl. a Tmp. esetében egy olyan felület nyílik meg ahol a hőmérséklet profilt tudunk beállítani, ha mondjuk 5 óra alatt 30 oC-ról 15 oC-ra kívánjuk csökkenteni a hőmérsékletet. Szintén innen érjük el a PID beállításokat. A középső mező, ahol az aktuális érték jelenik meg, innen kiindulva megváltoztathatjuk a beállított értéket, pl. ha gyorsan le akarjuk hűteni 10 oC-ra a fermentlevet.
A fermentor bal oldalán a szenzorokból kiolvasott értékeket látjuk a jobb oldalon fentről lefelé Sav pumpa sebessége, alatta az átpumpált sav mennyisége mL-ben, majd a bázis és a tápanyag pumpák értékei. A PWM, I, U, P értékek a felhasznált energia mennyiségéről tájékoztatnak. Végül a legalsó mező a fermentor tömegét mutatja.
Azt hiszem az lesz a legegyszerűbb, ha elejétől a végéig elmesélem, hogy is zajlik egy fermentáció és az egyes részeknél részletezem, hogy milyen adatok keletkeznek, amit majd kezelni kell. Ez a későbbiekben egy jó kiindulási alap lesz, hogy demonstrálja az információ áramlást és a megértést két különböző tudományterület között. Jelen esetben egy fermentáció közben képződő adatmennyiséget kell megfelelő módon adatbázisban eltárolni, a képződött adatokon matematikai műveleteket végrehajtani, azokat ábrázolni, értékelni, más adatokkal összehasonlítani.
Első és második nap (inokulum készítés)
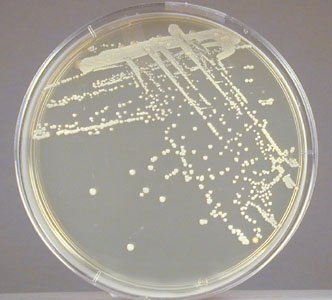
1. Colonies
A törzsfejlesztő csoporttól megkapjuk a genetikailag módosított törzset. Az 1-es képen az egy Petri-csésze, ami kb. 2/3-ig valamilyen tápközeggel LB-agar vagy MM-agar van töltve, ez egy szilárd tápközeg, ami mindenféle anyagot tartalmaz, ami a kívánt mikroorganizmus szaporodásához szükséges. Itt tehát tudnak szaporodni és úgynevezett telepeket képeznek, amik milliós nagyságrendben tartalmaznak élő sejteket. Ami információt innen le kell menteni, az az, hogy mikor szélesztették a sejteket, ez azért fontos, hogy tudjuk milyen idős a telep. Ahhoz, hogy  rendesen megnőjenek 1-2 napig kell őket inkubálni 370C-on. Optimális esetben mi vesszük ki az inkubátorból, és visszük a következő lépésbe, de előfordul, hogy pár napot állnak a hűtőben. A következő lépésben oltókaccsal kiemelünk egy telepet és LB, vagy MM tápoldatban elszuszpendáljuk. Ez úgy történik, hogy van egy 50ml-es Falkon cső, amiben 10ml tápoldat van. Az oltókaccsal felveszünk egy telepet, vagy akár többet és átvisszük a tápoldatba, kicsit megrázzuk, hogy a sejtek leoldódjanak. Ezt nevezzük inokulum 1.-nek, van, hogy ezzel oltjuk be a fermentort, ha a kezdő térfogata 100-200ml, de, ha nagyobb a fermentorunk, akkor egy második inokulumot is kell készítenünk, mivel arányosan nagyobb térfogatot kell használnunk az inokulomból. Ehhez egy kicsit nagyobb, úgynevezett módosított Erlenmeyer lombikot használunk, ebben az esetben egy 250ml-est, amiben 40ml tápoldat van, ezt oltjuk be a korábban készített inoculum 1-el. Az inokulum 1 esetében, mivel a kezdeti sejtszám igen kicsi ezért ezt min. 12 órát, az inokulum 2-t 5-8 órát inkubáljuk, itt mi állítjuk be a kezdeti sejtszámot. Az inokulum kettő esetében, ahol ismerjük a kezdeti, valamit a végső sejtszámot, így lehetőségünk van ebből növekedési paramétereket számolni, úgymint a maximális növekedési rátát, vagy a generációs időt, amik a törzsünkre jellemző paraméterek és fontosak a fermentáció megtervezésénél. Visszakanyarodva az inokulum 1-hez, amit beoltottunk és 16 órát 33oC-on inkubáltunk. Egy zavaros tejszerű szuszpenziót kapunk, aminek meg kell határozni az OD600 (Optical Density) értékét. 600, mert ezen a hullámhosszon végezzük a mérést. Lényegben egy spektrofotometriás módszer, aminek a lényege, hogy minél nagyobb a sejtsűrűség annál kevesebb fény jut át a küvettán, amiben a 10-szeresére hígított fermentlevet vizsgáljuk.
rendesen megnőjenek 1-2 napig kell őket inkubálni 370C-on. Optimális esetben mi vesszük ki az inkubátorból, és visszük a következő lépésbe, de előfordul, hogy pár napot állnak a hűtőben. A következő lépésben oltókaccsal kiemelünk egy telepet és LB, vagy MM tápoldatban elszuszpendáljuk. Ez úgy történik, hogy van egy 50ml-es Falkon cső, amiben 10ml tápoldat van. Az oltókaccsal felveszünk egy telepet, vagy akár többet és átvisszük a tápoldatba, kicsit megrázzuk, hogy a sejtek leoldódjanak. Ezt nevezzük inokulum 1.-nek, van, hogy ezzel oltjuk be a fermentort, ha a kezdő térfogata 100-200ml, de, ha nagyobb a fermentorunk, akkor egy második inokulumot is kell készítenünk, mivel arányosan nagyobb térfogatot kell használnunk az inokulomból. Ehhez egy kicsit nagyobb, úgynevezett módosított Erlenmeyer lombikot használunk, ebben az esetben egy 250ml-est, amiben 40ml tápoldat van, ezt oltjuk be a korábban készített inoculum 1-el. Az inokulum 1 esetében, mivel a kezdeti sejtszám igen kicsi ezért ezt min. 12 órát, az inokulum 2-t 5-8 órát inkubáljuk, itt mi állítjuk be a kezdeti sejtszámot. Az inokulum kettő esetében, ahol ismerjük a kezdeti, valamit a végső sejtszámot, így lehetőségünk van ebből növekedési paramétereket számolni, úgymint a maximális növekedési rátát, vagy a generációs időt, amik a törzsünkre jellemző paraméterek és fontosak a fermentáció megtervezésénél. Visszakanyarodva az inokulum 1-hez, amit beoltottunk és 16 órát 33oC-on inkubáltunk. Egy zavaros tejszerű szuszpenziót kapunk, aminek meg kell határozni az OD600 (Optical Density) értékét. 600, mert ezen a hullámhosszon végezzük a mérést. Lényegben egy spektrofotometriás módszer, aminek a lényege, hogy minél nagyobb a sejtsűrűség annál kevesebb fény jut át a küvettán, amiben a 10-szeresére hígított fermentlevet vizsgáljuk.
Összefoglalva nézzünk egy konkrét példát, hogy lássuk milyen és mennyi adat keletkezik.
LB-agaron megkaptuk a GG1245 nevű genetikailag módosított E.coli mutánsunkat, amiből elindítottuk az inokulum 1-et, 16 órán keresztül 330C-on inkubáltuk, majd megmértük az OD600 értékét. Ebből egy második inokulumot indítottuk, amit 6 órán keresztül 33oC-on inkubáltunk, majd ennek is megmértük az OD600 értékét. Ismeretlen törzsek esetében többszörös mintavétel is szükséges, mondjuk óránként, ami alapján a növekedési görbét is fel tudjuk venni, de ezen adatokat majd külön kezeljük.
| Inokulum/általános adatok | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Szélesztés időpontja | Antibiotikum | Tápközeg | |||||||
| Plate | 2018-05-24 | Nem | LB-agar-glükóz | ||||||
| Használt inokulum | Beoltás időpontja | Antibiotikum | Tápközeg | Inokulum térfogata [ml] | Teljes térfogat [ml] | Inkubációs idő [h] | Hőm. [oC] | OD | |
| Inokulum 1. | Plate | 2018-05-25 12:22 | Nem | LB-glükóz | – | 10 | 18 | 33 | 4 |
| Inokulum 2. | Inoc. 1. | 2018-05-26 09:22 | Nem | LB-glükóz | 2 | 40 | 5,17 | 33 | 1,6 |
| Beviteli mezők összesen 21 db |
Ezek lesznek az alapértelmezett beviteli mezők, de ezek mellett természetesen lehetőséget kell adni a felhasználónak, hogy ezt kedvükre változtathassák, oszlopokat, sorokat tudjanak hozzáadni vagy elvenni. Egy másik, de ehhez kapcsolódó almenü, ami szervesen kapcsolódna ide lehetőséget adna az OD értékének követésére az idő függvényében. Ezen menük a GUI bal oldalán lennének elhelyezve a következő elrendezés szerint. A kiinduló pont lenne maga a fermentációnak a sorszáma, vagy egy jegyzőkönyv szám.
GGF-18311
- Fermentációs paraméterek
- Média összetétel
- Trace mineral solution
- Média összetétel anyagmérleg
- Média összetétel
- Inokulum
- Általános adatok
- Növekedési paraméterek
- Online adatok
- Offline adatok
- Kiértékelés, konklúzió
Ismeretlen törzsek esetében fontos meghatározni a növekedési paramétereket mielőtt elkezdjük a fermentációt, ez hasonlóan megy mint ahogy előbb leírtuk, a különbség csak annyi, hogy itt az inokulum 2. esetében több mintát veszünk, általánosan minden órában.
| Inokulum/növekedési paraméterek | |||||||
|---|---|---|---|---|---|---|---|
| Beoltás időpontja | Inokulum térfogata [ml] | Teljes térfogat [ml] | Inoculum 1. OD | Tápközeg | Antibiotikum | Hőmérséklet [oC] | |
| Paraméterek | 2018-05-26 09:22 | 2 | 40 | 4 | LB-glükóz | Nem | 33 |
| Idő [h] | OD600 | Generációs idő | Növekedési ráta | Generációk száma | Megjegyzés | ||
|
Mérési adatok |
0 | 0,2 | |||||
| 1,17 | 0,3 | ||||||
| 2,33 | 0,4 | ||||||
| 3,33 | 0,7 | ||||||
| 4,33 | 1,1 | ||||||
| 5,17 | 1,6 | ||||||
| Beviteli mezők összesen 25 db |
| Matematikai műveletet tartalmazó mezők összesen 19 db |
Az OD értékét a 0 időpillanatban az ismert adatok alapján automatikusan kiszámoltathatjuk. Az inoculum 1-ből 2 ml-t használunk, hogy beoltsuk az inoculum 2-t, aminek a teljes térfogata 40ml. 40ml/2ml = 20, ami a hígítás mértéke. Az inoculum 1. OD-ja négy, így ha ennek 2 ml-ét 20-szorosára hígítjuk 0,2 kapunk, ami a inoculum 2. kiindulási OD értéke.
\[ OD_{t=0}=\frac{4}{\frac{40}{2}} = \frac{2}{40}*4 = 0.2 \]
A generációs idő számítása
\[ G=\frac{t}{3.3log\left ( \frac{N}{N_{0}} \right )} \]
Növekedési ráta számítása
\[ \mu = \frac{ln\left ( \frac{N}{N_{0}} \right )}{t} \]
Generációk száma
\[ n=\frac{t}{G} \]
Egy korábban készített online kalkulátor ITT kipróbálható.
Ugyanezen a kezelőfelületen ugyancsak szükséges grafikusan is ábrázolni a mért értékeket, amit a riport részbe szintén át kell tudni majd emelni. Erre van egy plugin, amit itt használok, ez majdnem megfelel. Ezt két funkcióval kellene kiegészíteni, az egyik a többszörös y-tengely, a másik, hogy lehessen trendvonalat illeszteni a görbékhez, valamint megjeleníteni az ehhez tartozó egyenletet. A két leggyakrabban használt trendvonal a lineáris és az exponenciális.
[visualizer id=”302″]
Akár azon is elgondolkodhatunk, hogy a mért értékeket valamilyen külső programba API-n keresztül továbbítsuk, amivel komolyabb matematikai műveleteket is végre lehet hajtani. Itt egy példa, ez a Plotly-val készült.
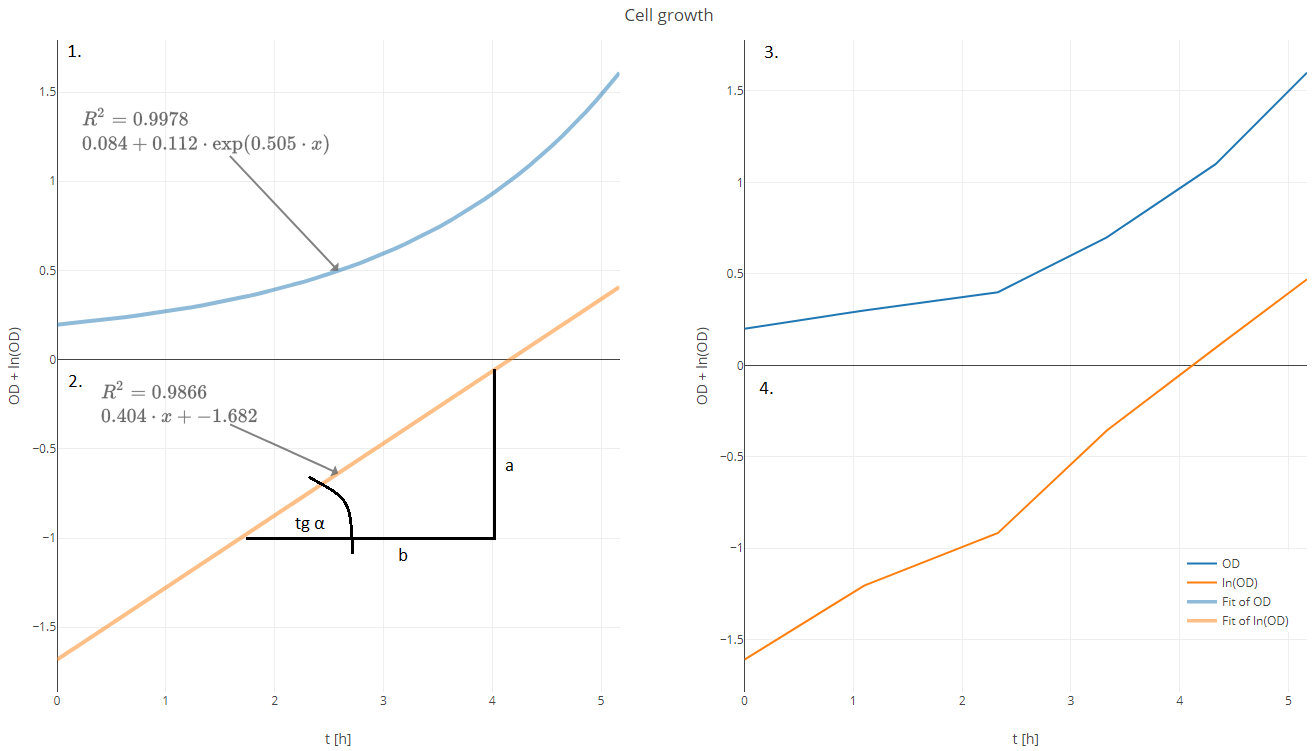
Exponenciális függvény egyenlete
|
\[ y=0.084+0.112*\exp(0.505*x) \] |
\[ x = \frac{ln\left ( \frac{y-0.084}{0.112} \right )}{0.505} \] |
Lineáris függvény egyenlete fél logaritmikus
|
\[ y=0.404*x-1.682 \] |
\[ x=\frac{y+1.682}{0.404} \] |
Ebből az OD értéke
\[ OD =e^{y} \]
Amelyik összefüggést még jó ha tudjuk, a növekedési ráta egyenlő a tgα értékével
\[ tg\alpha = \frac{a}{b} = \mu \]
A második nap végére elkészül az inokulum 2. amit majd a nagy fermentor beoltásához fogunk használni. Remélem nem volt nagyon megterhelő, mert ami ezután következik, abban nem lesz köszönet. Mondhatjuk, hogy szívás ez az egész tudomány dolog és jobb lett volna, ha valami más szakmát választottunk volna. Egyszer a főnököm megkérdezett minket, hogy milyen más szakmát választanánk ehelyett, az egyik munkatársam kamion sofőr akart lenni és szívesen lennék kertész.
Második nap (fermentor előkészítése és beoltása)
Vagy négy év volt, (egyetem után) mire teljesen átláttam az egész folyamatot és magabiztosan tudtam használni a fermentorokat, kalibrálás, beállítás, hibaelhárítás, receptírás, kísérlettervezés meg a társai. Most pedig itt állunk és próbáljuk megtervezni a saját fermentorunkat szoftverestől, hardverestől, edényestől, vagyis mindenestől, nem vagyunk normálisak.
A második nap végére, mire az inokulum 2 elkészül, sok mindennel meg kell lenni, először is el kell készíteni a tápközeget, ezzel folytatjuk most.
| Média összetétel menü | |||||||
|---|---|---|---|---|---|---|---|
| Dátum | 2018-05-26 | Operátor | KM | Sarzs szám | GGF-18311 | ||
| Média összetétel | Végtérfogat [L] | 1 | |||||
| Név | Képlet | Móltömeg [g/mol] | Koncentráció [g/L]; [ml/L] | Mólkoncentráció [mmol/L] | Bemérendő | Mértékegység | Gyártási szám |
| Disodium hydrogen phosphate | Na2HPO4 | 141,96 | 6 | 42.27 | 6 | g | WTY235687 |
| Potassium dihydrogen phosphate | KH2PO4 | 136,086 | 3 | 22.04 | 3 | g | ZHU364548 |
| Ammonium chloride | NH4Cl | 53,49 | 1 | 18.70 | 1 | g | uhz12548 |
| Sodium chloride | NaCl | 58,4 | 0.5 | 8.56 | 0.5 | g | ugdt125487 |
| Magnesium sulfate | MgSO4 | 120,366 | 1 | 8.31 | 1 | g | gtf125484 |
| Trace mineral solution | Complex | – | 10 | – | 10 | mL | TMS011 |
| Polypropylene glycol | – | – | 200 | – | – | µL | 125487 |
| A sókat ennyi ioncserélt vízben kell feloldani | 879 | mL | |||||
| Glükóz | C6H12O6 | 180,156 | 20 | 111.01 | 20 | g | |
| A szénforrást ennyi vízben kell feloldani és autóklávozás után külön hozzáadni a fermentorhoz. | 100 | mL | |||||
| Thiamine (vitamin) | C12H17N4OS+ | 265.35 | 0.012 | 0.045 | 12 | mg | |
| Sterilre szűrés után adjuk a fermentorhoz | 1 | mL | |||||
| Extra tápanyag | Végtérfogat [L] | 1 | |||||
| Glükóz | C6H12O6 | 180,156 | 400 | 2220.30 | 400 | g | |
| A szénforrást ennyi vízben kell feloldani és autóklávozás után összeönteni a sóoldattal | 600 | mL | |||||
| Magnesium sulfate | MgSO4 | 120,366 | 13 | 108 | 13 | g | |
| Ammonium-sulfate | NH4SO4 | 132,14 | 4 | 30.27 | 4 | g | |
| TMS | Complex | – | 50 | – | 50 | mL | |
| Polypropylene glycol | – | – | 2 | – | 2 | mL | |
| A sókat ennyi ioncserélt vízben kell feloldani és autóklávozás után összeönteni a szénforrást tartalmazó oldattal | 350 | mL | |||||
Média összetételből nyíló 2. almenü.
| A Trace mineral solution almenü | |||||||
|---|---|---|---|---|---|---|---|
| Dátum | 2018-04-19 | Operátor | KM | Sarzs szám | TMS012 | ||
| TRACE MINERAL SOLUTION | Végtérfogat [L] | 1 | |||||
| Név | Képlet | Móltömeg [g/mol] | Koncentráció [g/L]; [ml/L] | Mólkoncentráció [mmol/L] | Bemérendő | Mértékegység | Gyártási szám |
| Manganese(II) sulfate hydrate | MnSO4.H2O | 151.00 + 18.015 | 0.5 | 3.31 | 0.56 | g | |
| Iron(II) sulfate heptahydrate | FeSO4.7H2O | 151.91 + 126.105 | 2 | 13.17 | 3.66 | g | |
| Ammonium molybdate | (NH4)2MoO4 | 196.01 | 0.1 | 0.51 | 0.1 | g | |
| Zinc sulfate heptahydrate | ZnSO4.7H2O | 161.47 + 126.105 | 0.3 | 1.58 | 0.3 | g | |
| Copper (II) sulfate pentahydrate | CuSO4.5H2O | 159.61 + 90.08 | 0.1 | 0.63 | 0.1 | g | |
| Beviteli mezők összesen 29 db |
| Matematikai műveletet tartalmazó mezők összesen 33 db |
| Ennek az értéke a végtérfogat értékének a függvénye összesen 2 db |
| Legördülő menü választási opcióval összesen 14 db |
| Ehhez tartozik egy almenü, ami részletesen definiálja az összetételét összesen 1 db |
| Automatikusan kitöltődő mező függően a Név mezőtől összesen 28 db |
Itt az összes esetben csak egyszerű matematikai műveletekről van szó, a móltömeg kiszámításánál egy egyszerű osztás, ha kristályvizet tartalmaz a só, akkor pedig többet kell bemérni, ez sem bonyolultabb.
|
\[ n=\frac{m}{M} \] |
\[ m_{cryst.}=\frac{m_{anhyd.}*M_{cryst.}}{M_{anhyd.}} \] |
A következő menüpont már a kiértékelés része, itt lehet részletes információt kapni az ion összetételről, azt összevetni online mérési adatokkal. Itt a Média összetétel egyes celláiból kiolvasott értékeket összegzi pl. összes NH4+, Mg2+, Na+, PO43- ezeket lehetőség van összevetni online mérési eredményekkel. Továbbá lehetőség van a pH beállításhoz használt sav, lúg iontartalmát automatikusan hozzáadni az anyagmérleghez.
Mielőtt belekezdenénk a következő táblázatba, nézzük, hogy is állunk. Megcsináltuk tehát a Tápközeget a Média összetétel adatlap alapján, amit korábban kitöltöttünk, ehhez kell majd rendelni egy számot, mondjuk M1. Ez definiálja a Média összetételét, ha ezen változtatunk, mert mondjuk a fermentáció 60. órájában elfogy a PO43+, akkor a következő M2-ben megemeljük a foszfát mennyiségét. Itt mindenképpen kizárólag egy paraméter szabad változtatni, hogy a kiinduló Média összetételből a továbbiak könnyen leszármaztathatóak legyenek. M1-hez rendeljünk hozzá egy koncentráció értéket mondjuk 18g/L, amit 50 óra után értünk el. A megfigyelésünk szerint a 40, órában már alacsony volt a PO43+ szint, ezért következőleg a kezdeti médiában eleve megemeltük ennek koncentrációját. M1-ben a Potassium dihydrogen phosphate (legyen x) kezdeti koncentrációja 3g/L, amit az M2-ben megemeltünk 4 g/L-re (x+1), ahol azt tapasztaltuk, hogy a koncentráció az 50. órában 22g/L lett 1,33-szor annyi Potassium dihydrogen phosphate használatával, ennek következtében 1,22 szeresére nőtt a termelés. Erre kellene ráhúzni egy matematikai összefüggést, ha mondjuk M1-et akarjuk összehasonlítani az M65-el.
Ebben az almenüben találjuk a teljes anyagmérleget.
| Média összetétel anyagmérleg | ||||||
|---|---|---|---|---|---|---|
| g/mol | weight (g) | mmol | Individual ions | |||
| Na2HPO4 | 2Na+ | H+ | PO43- | |||
| Disodium hydrogen phosphate | 141,96 | 6 | 42.27 | 84.54 | 42.27 | 42.27 |
| KH2PO4 | K+ | 2H+ | PO43- | |||
| Potassium dihydrogen phosphate | 136,086 | 3 | 22.04 | 22.04 | 44.08 | 22.04 |
| NH4Cl | NH4+ | Cl– | ||||
| Ammonium chloride | 53,49 | 1 | 18.70 | 18.70 | 18.70 | |
| NaCl | Na+ | Cl– | ||||
| Sodium chloride | 58,4 | 0.5 | 8.56 | 8.56 | 8.56 | |
| MgSO4 | Mg2+ | SO42- | ||||
| Magnesium sulfate | 120,366 | 1 | 8.31 | 8.31 | 8.31 | |
| Complex. | Mn2+ | Fe2+ | MoO4– | Zn2+ | Cu2+ | SO42+ |
| Trace mineral solution | 0.005 | 0.02 | 0.001 | 0.003 | 0.001 | 0.029 |
| NH4+ | ||||||
| 0.002 | ||||||
| C6H12O6 | C6H12O6 | |||||
| Glükóz | 180,156 | 111.01 | ||||
| C12H17N4OS+ | C12H17N4OS+ | |||||
| Thiamine (vitamin) | 265.35 | 0.045 | ||||
| C12H17N4OS+ | C12H17N4OS+ | |||||
| Thiamine (vitamin) | 265.35 | 0.045 | ||||
| Extra tápanyag | ||||||
| g/mol | weight (g) | mmol | Individual ions | |||
| C6H12O6 | ||||||
| Glükóz | 180.156 | 400 | 2220.30 | |||
| MgSO4 | Mg2+ | SO42- | ||||
| Magnesium sulfate | 120.366 | 13 | 108 | 108 | 108 | |
| NH4SO4 | NH4+ | SO42- | ||||
| Ammonium-sulfate | 132,14 | 4 | 30.27 | 30.27 | 30.27 | |
| Complex. | Mn2+ | Fe2+ | MoO4– | Zn2+ | Cu2+ | SO42+ |
| Trace mineral solution | 0.025 | 0.1 | 0.005 | 0.015 | 0.005 | 0.145 |
| NH4+ | ||||||
| 0.01 | ||||||
Itt lehet még fokozni a dolgot, hogy az egyes ionok összes koncentrációját is lehessen látni, sőt azt is, hogy a feed batch szakaszban hogyan változik az ionkoncentráció, de ezt majd később.
| A Média összetétel menü függvénye db |
| Matematikai műveletet tartalmazó mezők összesen db |
Összefoglalás képen csak annyi, hogy ezek a menük mindannyian a Fermentációs paraméterek főmenüből származtathatóak, amit nevezzünk mester dokumentumnak. Ez a mesterdokumentum tartalmaz minden adatot a fermentációs paraméterektől kezdve, mint pH, pO2, keverés sebessége, tápanyag adagolás sebessége, tartalmazza a média részletes összetételét. Ezt a dokumentumot a kísérlet megtervezője állítja össze, ennek van egy azonosítója mondjuk M és egy száma, ami a változást jelzi az előzőhöz képest, legyen az első M1. Az M1-hez tartozik mondjuk 10 változó, ha változtatunk valamelyiken M2-t kapunk.
| M1 | M2 | M3 | M4 | |
| A | 2 | 3 | 3 | 3 |
| B | 2 | 2 | 3 | 3 |
| C | 2 | 2 | 2 | 3 |
| D | 2 | 2 | 2 | 2 |
| E | 2 | 2 | 2 | 2 |
| F | 2 | 2 | 2 | 2 |
| G | 2 | 2 | 2 | 2 |
| H | 2 | 2 | 2 | 2 |
| I | 2 | 2 | 2 | 2 |
Ehhez matematika egyenletet tudunk rendelni, az alapján, hogy az M1-es eljáráshoz a fermentáció 90. órájában 10g/L-es produktivitás társult, az M2-hez 12g/L, ez 16,7%-os javulást jelent. Ez annak volt köszönhető, hogy az A változó értékét megemeltük egyel.
M2 = M1(A+1)
Ezt is majd később részletezzük. Megvan tehát a mester dokumentum az M1-M4. Szeretnénk indítani egy fermentációt az M2-es eljárás szerint. A bal oldali menüsávból elindítjuk a fermentáció indítása varázslót, itt definiálnunk kell a fermentáció számát, ami az előzőek alapján GGF-18311. Ezzel egy aktív fermentációs eljárást indítunk, itt ha megadjuk a mesterdokumentum számát, amit hozzárendelünk ehhez a fermentációhoz. Az online paramérerek automatikusan beállítódnak, (keverés sebessége, pH stb.) a média összetétel form automatikusan kitöltődik, ami alapján elkészítjük majd a tápközeget. Ezután következik a szenzorok kalibrálása, mint a pH és az oxigén szenzoré.
A média elkészítéséhez az egyes anyagok bemérését olyan mérlegen végezzük, ami kapcsolódik egy Raspberry pi-hez, ami kiolvassa az értéket és http-n továbbküldi a megfelelő fermentor egységhez, amit az IP címe definiál. Itt az adatok beíródnak a média összetétel adatlap aktív mezőjébe.
| Mester file | |||||||
| Név | Képlet | Móltömeg [g/mol] | M0 | M1 | M2 | M3 | M4 |
| Basal média | |||||||
| Koncentráció [g/L]; [ml/L] | |||||||
| Disodium hydrogen phosphate | Na2HPO4 | 141,96 | 6 | ||||
| Potassium dihydrogen phosphate | KH2PO4 | 136,086 | 3 | ||||
| Ammonium chloride | NH4Cl | 53,49 | 1 | ||||
| Sodium chloride | NaCl | 58,4 | 0.5 | ||||
| Magnesium sulfate | MgSO4 | 120,366 | 1 | ||||
| Trace mineral solution | Complex | – | 10 | ||||
| Polypropylene glycol | – | – | 0.2 | ||||
| Autoklávozás után hozzáadandó | |||||||
| Glükóz | 20 | ||||||
| Thiamine | 0.012 | ||||||
| Extra tápanyag | |||||||
| Glükóz | C6H12O6 | 180,156 | 400 | ||||
| Magnesium sulfate | MgSO4 | 120,366 | 13 | ||||
| Ammonium-sulfate | NH4SO4 | 132,14 | 4 | ||||
| TMS | Complex | – | 50 | ||||
| Polypropylene glycol | – | – | 0.2 | ||||
| Beállítások | |||||||
| pH | 6,8 | 6,8 | 6,8 | 6,8 | 6,8 | ||
| Dissovled O2 (%) | 25 | 25 | 25 | 25 | 25 | ||
| Air Flow (l/min./l ) | 1 | 1 | 1 | 1 | 1 | ||
| Stir (rpm) | 300 | 300 | 300 | 300 | 300 | ||
| Temp Gr (0C) | 30 | 30 | 30 | 30 | 30 | ||
| Temp Pr (0C) | 28 | 28 | 28 | 28 | 28 | ||
| First feed rate (ml/l/h) | 5 | 5 | 5 | 5 | 5 | ||
| Second feed rate (ml/l/h) | 3 | 3 | 3 | 3 | 3 | ||
Ezzel a végére is értünk az első két almenü a Fermentációs paraméterek és az Inokulum részletezésének. A következőekben az Online adatok, Offline adatok, Kiértékelés, konklúzió almenüket külön tárgyaljuk.
Képek forrása
1 https://www.thinglink.com/scene/893540211361841152
Projekt kezdete: 2018.07.01.
| MÉRFÖLDKÖVEK | TARTALMA | IDŐIGÉNYESSÉG | |
|---|---|---|---|
| M0 | Státusz |
|
– |
| M1 | Tervezés |
|
2 hónap |
| M2 | Fejlesztés |
|
6 hónap |
| M3 | Belső tesztelés és javítás |
|
4 hónap |
| M4 | Külső tesztelés és finomhangolás |
|
5 hónap |
| M5 | Továbbfejlesztés, blokkosítás |
|
4 hónap |
| M6 | Piacra lépés |
|
3 hónap |
| Jelenlegi állapot |
-
- jFermi brossura -> jfermi_brochure.pdf
- Mit tartalmaz a csomag -> What-is-in-the-package.pdf
- jFermi termékösszefoglaló -> jFermi-one-pager-eng.pdf
Szeretne kapcsolatba lépni velünk?
Ezen az Email címen info@jfermi.com várjuk levelét vagy hívását a +36305442583-as telefonszámon!

8:00 am – 5:00 pm
8:00 am – 5:00 pm
8:00 am – 5:00 pm
8:00 am – 5:00 pm
8:00 am – 5:00 pm
Closed
Closed
Rólunk
