Cupriavidus necator autotróf módon való növesztéséhez összeállítottunk egy egyszerű rázatott lombikos kísérletet, ahol hidrogén/szén-dioxid/oxigén/nitrogén atmoszféra alatt tenyészthetjük a sejteket. Egy 100mL-es Erlenmeyer lombik, a szája szilikon dugóval lezárva, ez egy tűvel átszúrva, 0.2μm szűrővel ellátva alkotja a kezdetleges bioreaktorunkat. Mivel a CO2 a Calvin cikluson keresztül szerves anyaggá konvertálódik, a molekuláris hidrogén pedig vízzé oxidálódik, ezért egy térfogat csökkenési reakcióról beszélünk, amit a következő Ishizaki és Tanaka által meghatározott egyenlettel írhatunk fel, ebből, egy molekulatömeget is tudunk számolni:
21.36 H2 + 6.21 02 + 4.09 CO2 + 0.76 NH3 → C4.09H7.13O1.89N0.76 + 18.7 H20 [1]
A minimál tápoldat felett, a lombikban egy túlnyomásos gázteret hozunk létre, ami a reakció előrehaladtával folyamatosan csökkenni fog. A hidrogén mérete miatt egy sima lufi erre a célra nem alkalmas, mert a gáz nagyon gyorsan kidiffundál belőle, erre a célra egy vastag falú labda belsőt érdemes használni. A gázkeveréket egy ballonba töltjük bele, így a pontos koncentrációt nehéz beállítani, de térfogatarányosan úgy kell a gázokat betölteni, hogy az arányuk körülbelül 85 rész hidrogén : 5 rész CO2 : 10 rész levegő legyen. Ezzel az összeállítással végeztük a következő kísérlet sorozatot.
 1. Ábra |
 2. Ábra |
 3. Ábra |
A vizsgálandó törzset Cupriavidus necator DSM 428 (Strain designation: H 16, H16) a German Collection of Microorganisms and Cell Cultures GmbH-tól fagyasztva szárított formában rendeltünk, amit nutrien agar-on regeneráltunk.

Az ampulla tartalmát 500-500 μL LB médiumban elszuszpendáltuk, majd fél óra állás után 10-10 mL LB médiumba oltottuk, 24 órát rázattuk 30oC-on, majd 50%-os glicerines oldattal 1-1 arányban kevertük, ezután -80oC-os hűtőben 2 mL-es Eppendorf csövekben letároltuk. Az OD: 0,8-1 között van →working cell bank (WCB1).
20 mL MCN1 médiumot 30 g/L szénforrás mellett 1 mL WCB1 letárolt tenyészettel inokuláltunk, két hét inkubációt követően (30 oC, 300 rpm) ennek 18mL-ét OD: 24.44 értéknél lecentrifugáltunk, kétszer mostuk MCN1 (fruktóz nélkül) tápoldattal, ismét lecentrifugáltuk, majd 16mL tápoldattal szuszpendáltuk (OD: 24). Ennek 1mL-ét használtuk a 18mL MCN1 (fruktóz nélkül) tápoldat beoltására. Továbbiakban leoltottunk még két lombikot, amik 10g/L fruktóz szénforrást tartalmaztak, valamint egy vakot, ami sem szénforrást, sem gázelegyet nem tartalmazott. A szénforrást és gézelegyet tartalmazó lombikban nem tapasztaltunk növekedést. Szerves szénforráson egy hosszabb Lag fázis után (40-70h) a tenyészet a gyorsulási, majd az exponenciális szakaszba lépett, az egyik esetben 165 óra után a másiknál 237 óránál érte el a maximális OD értéket, ami 23 és 22.7 volt. A 150 óra után a hanyatló fázisba léptek.
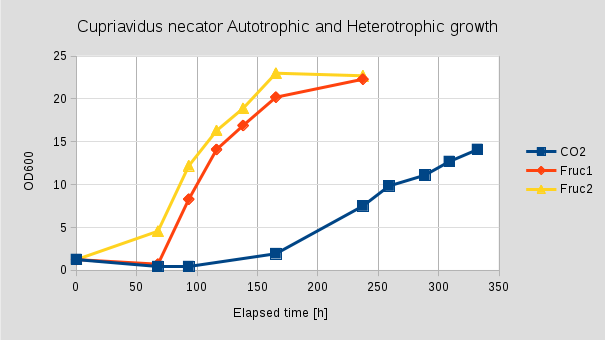
4. Ábra
Szén-dioxidon és hidrogénen egy még hosszabb Lag fázis (100 óra) után lépett a növekedési fázisba a tenyészet, ami a 332 óráig folyamatos növekedésben volt, a maximális OD: 14.1. Maximális növekedési rátát 0,0206 h-1 a 93 és a 165 óra között érte el. Ez szerves szénforráson, rázatott lombikban maximálisan 0.0959 h-1 volt. Fermentorban, jól levegőztetett körülmények között a 0.159 h-1 értéket is elérte [2020-09-15 Cupriavidus necator].
A tenyészetet 332.17 óra után lecentrifugáltuk, a felülúszó 15 mL lett. A kezdeti pH 7.41 a fermentáció végére pH 6.51-re csökkent. A mintavételi veszteség 2,2 mL, így a kiindulási térfogathoz (19 mL) viszonyítva 1.8 mL párolgási veszteséggel kell számolnunk. Sűrűséget és száraz tömeget is mértünk belőle, ez az alábbi táblázatban látszik.
14.1 OD értékhez 3.5 g/L száraz tömeg tartozik. A sűrűsége 1.0111 g/L.
| Eppendorf m | Epp+2mLminta m | Epp+sejt m | Folyadék tömeg | Száraz tömeg | Sűrűség [g/cm] | Konc. [g/L] |
| 1.0785 | 3.0999 | 1.0854 | 2.0214 | 0.0069 | 1.0107 | 3.45 |
| 1.0652 | 3.1082 | 1.0722 | 2.0430 | 0.0070 | 1.0215 | 3.50 |
| 1.0651 | 3.0881 | 1.0722 | 2.0230 | 0.0071 | 1.0115 | 3.55 |
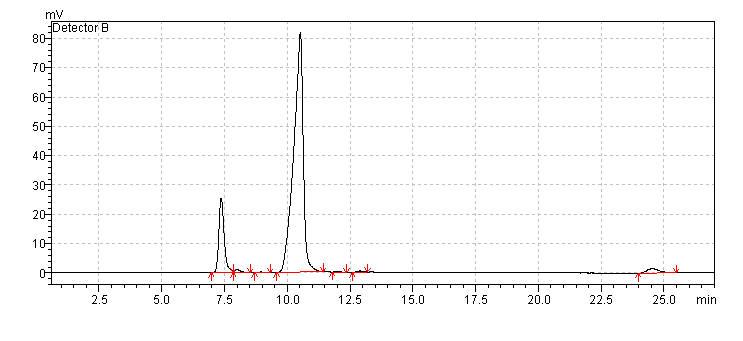
HPLC mérés alapján szerves savak, szénhidrátok nem voltak kimutatható mennyiségben a mintában, ezzel a módszerrel mérve*. A három látható csúcs a médiumból és a futtató elegyből jön.
Ebből a tenyészetből kiindulva indítottunk egy következő rázatott lombikos kísérletet 3 párhuzamossal + egy vak. MCN2 (fruktóz nélkül) tápoldatot használtunk, dupla annyi (NH4)2SO4 és többféle nyomelem oldattal kiegészítve. 20-20mL, 0,5mL-el inokulálva. A kezdeti OD: 0,23. Az előző kísérlethez képest, itt annyiban tértünk el, hogy a gázelegyet nem egy ballonban vegyítettük össze. Az egyik ballonba töltöttük a levegőt, és a szén-dioxidot, a másikba a tiszta hidrogént. A gázokat egy gyors csatlakozós 5-ös elosztó 1-es és 5-ös részére csatlakoztattuk, 2,3,4-es portok vezették a gázokat a lombikokba.
 x3
x3
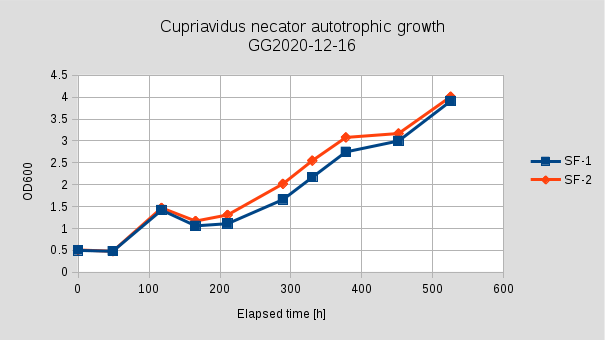
Az előző kísérlethez képest itt még hosszabb Lag fázist tapasztaltunk, ami 140 óra volt, a fermentáció kezdetén a sejtszám is csökkent. 300 óráig hasonló növekedési intenzitást mutattak, majd az SF1,3 lombikban ellaposodott a növekedési görbe. Mivel 3 párhuzamosról van szó, így a növekedésben mutatkozó jelentős különbség a gázelegy egyenlőtlen elosztása miatt, esetleg a steril szűrők átjárhatóságának különbségében keresendő. Az egyik ballont hidrogénnel, a másikat levegő és szén-dioxid elegyével töltöttük, elkerülve a robbanó elegy képződését. Azonban, ahogy csatlakoztattuk az 5-ös (CO2/Air), és 1-es (H2) portokhoz, a ballonokat, a kisebb (Air/CO2) ballonból a gáz egy része átnyomódott a nagyobb, hidrogént tartalmazó ballonba (Elastic Hysteresis). AZ 5-ös portnál fellépő nagyobb nyomás, gátolhatta a a hidrogén bejutását a lombikba, így a lassú növekedésnek talán ez is lehetett a magyarázata.
A legnagyobb növekedési rátát (0.0314 h-1, 0.0368 h-1, 0.0304 h-1) a fermentáció 141-188 óra közötti szakaszában értük el, ekkor az OD < 1.
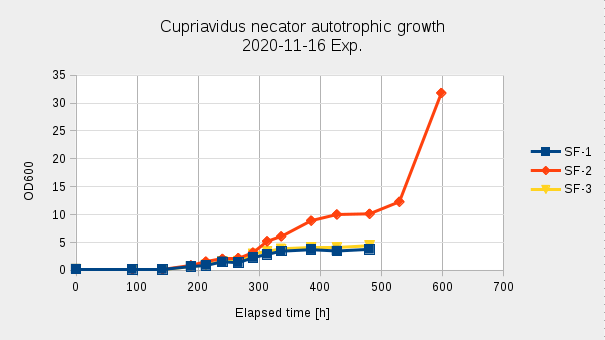
A korábbiaknál itt egy még hosszabb Lag fázist (130h +) tapasztaltunk. 335h után SF1 és SF3 esetében a fermentáció stacionárius fázisba lépett, SF2 esetében ez a 427h után következett be. Ezután minimális növekedés volt tapasztalható egészen 530h-ig, majd az 530h után jelentős növekedés volt megfigyelhető, 529h → 598h μ = 0.0138h-1, G = 50.4h, n = 1.4. 529h-nál sűrűség és szárazanyag tartalom mérést végeztünk, ezzel 10mL folyadékot eltávolítottunk az Erlenmeyer lombikból. ρ = 1.021 g/cm3; DCM = 4.4 g/L; OD = 12.3.
| Eppendorf m | Epp+2mLminta m | Epp+sejt m | Folyadék tömeg | Száraz tömeg | Sűrűség [g/cm] |
| 1.0812 | 3.074 | 1.09 | 1.9928 | 0.9964 | 0.0088 |
| 1.0742 | 3.1241 | 1.0831 | 2.0499 | 1.02495 | 0.0089 |
| 1.0836 | 3.1223 | 1.0924 | 2.0387 | 1.01935 | 0.0088 |
| 0.9898 | 3.0269 | 0.9985 | 2.0371 | 1.01855 | 0.0087 |
Ezzel 50%-al csökkentettük a teljes térfogatot, az utolsó 69h-ban jelentős növekedésnek indult a tenyészet, az 598. órában a pH 5.85-re csökkent, a maradék fermentléből ismét sűrűség és szárazanyag tartalom mérést végeztünk.
| Eppendorf m | Epp+2mLminta m | Epp+sejt m | Folyadék tömeg | Száraz tömeg | Sűrűség [g/cm] |
| 1.0701 | 3.0787 | 1.0842 | 2.0086 | 1.0043 | 0.0141 |
| 1.0741 | 3.1273 | 1.0887 | 2.0532 | 1.0266 | 0.0146 |
| 0.9923 | 3.0303 | 1.0069 | 2.038 | 1.019 | 0.0146 |
ρ = 1.017 g/cm3; DCM = 5.41 g/L; OD = 31.8.
 x2
x2
Az SF2 rázatott lombikos tenyészet (529h, OD:12.3) 1-1 mL-ével egy következő kísérletet indítottunk, MCN2 tápoldatban két párhuzamossal, az előbbivel megegyező kísérleti körülmények között.
* HPLC with a refrative index detection. Separation was achieved on BioRad (Hercules, CA, USA) Aminex HPX-87H (300 × 7.8 mm) column equipped with Micro-Guard Cation H+ Refill Cartridge (30 × 4.6 mm) guard column heated at 65 °C, using 5 mmol/L sulphuric acid 0.5 mL/min.
Hivatkozások
[1] Batch Culture of Alcaligenes eutrophus ATCC 17697 T Using Recycled Gas Closed Circuit Culture System; AYAAKI ISHIZAKI AND KENJI TANAKA; JOURNAL OF FERMENTATION AND BIOENGINEERING Vol. 69, No. 3, 170-174. 1990. [Letöltés]