Mind az oxigén, mind a CO2 szenzor ppm értéket ad vissza. Ezeket az értékeket kell az aktuális nyomás és hőmérséklet értékek függvényében mg/dm3 értékre alakítani.
Gázok esetében a ppm érték térfogat arányt jelent, így 1ppm = 1 µL gáz / 1 L levegő, azaz 1 L levegőben van 1 µL valamilyen gáz, a mi esetünkben ez most CO2, vagy O2.
Első lépéskét számoljuk ki a térfogatot V-t, és a moláris térfogatot, a Vm-et.
A standardállapotú gázok egységnyi anyagmennyisége (1 mól), 25,0 Celsius-fokon (298,15 kelvin), normál légköri nyomáson (101 325 Pa) 0,0245 m3 térfogatúak. Ez tehát magában foglalja a moláris térfogat meghatározását is: az ideális gáz moláris térfogata 101 325 Pa nyomáson és 25 °C hőmérsékleten 0,0245 m3/mol. A standardállapoton kívül megkülönböztetünk normálállapotot is[* 1].
Példa
Szenzorból bejövő értékek (CO2)
| Jele | Mértékegysége | Értéke | |
| Hőmérséklet | T | oC | 23.4 |
| Nyomás | P | mbar | 1013,25 |
| Relatív páratartalom | 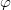 |
% | 43 |
| Koncentráció | c | ppm | 1100 |
Számoláshoz szükséges értékek
A hőmérsékletet át kell váltani kelvinre, a nyomást atmoszférára.
T(K) = T(°C) + 273.15 = 296.55 K
1 mbar = 0.000987 atm, így P = 1 atm
Amire még szükség van, az egyetemes gázállandó, ez
\[ R = 0.0821 \frac{L*atm}{mol*K} \]
Ez alapján kiszámolhatjuk 1 mól gáz térfogatát (24.35 L), 1atm nyomáson és 296K (23.4oC) hőmérsékleten
\[ V_{m} = \frac{n*R*T}{P} \]
amiből a moláris térfogat, az adott P, és T mellett (0.553 L/mol), MCO2 = 44.01 g/mol
\[ V_{n}= \frac{V}{n} \]
A gázok térfogata és anyagmennyisége közötti egyenes arányosságot leíró állandó a moláris térfogat (Vm): amely anyagi minőségtől független, viszont adott hőmérsékletre és nyomásra vonatkozik.
Innen már csak egy osztás, és megvan a gázkoncentráció, 1100 ppm / 0.553 L/mol = 1988,1 mg/m3
Itt a képlet rá:
\[ c = \frac{x [ppm]*M [g/mol])}{V [L]} \]
